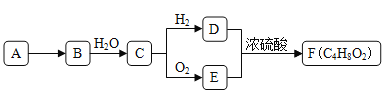
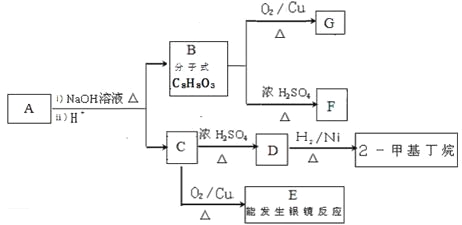
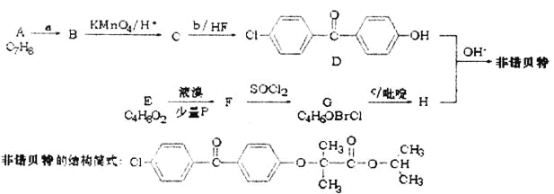
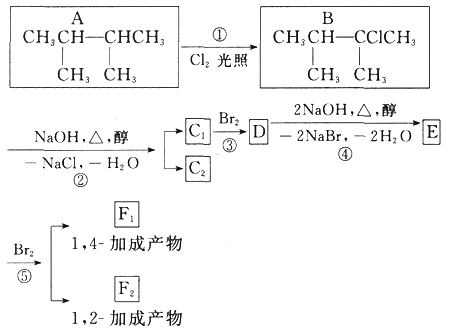
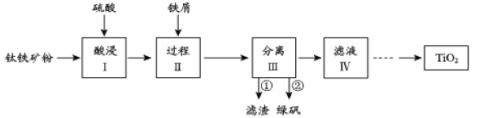
【题目】金属钛性能优越,被称为继铁、铝之后的“第三金属”。钛铁矿(主要成分为FeTiO3,含少量Fe2O3、SiO2等杂质)可用来制备TiO2,同时得到副产品绿矾(FeSO4·7H2O),工艺流程如图所示:
已知:①FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
②TiO2+易水解,只能存在于强酸性溶液中
(1)酸浸I中Fe2O3与稀硫酸反应的离子方程式:_____________________。
(2)过程II中加入适量铁屑的目的是_____________________________。
(3)分离III中步骤②得到绿矾的操作是__________________________。
(4)由滤液IV提取TiO2的过程如下:
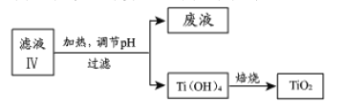
①请用化学平衡移动原理解释滤液加热煮沸的目的:_______________。
②由2Mg+TiCl4→Ti+2MgCl2反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据如表信息,需加热的温度略高于______℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -26.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
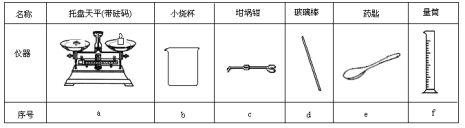
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
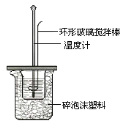
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度