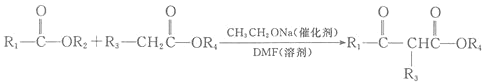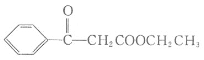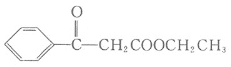题目内容
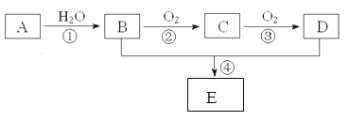
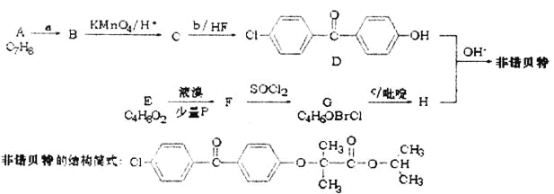
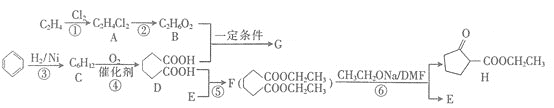
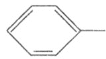
【题目】水杨酸己酯分子式为C13H18O3,具有花果香味,用作化妆品香料的定香剂,也用作烟草香精。它的一种同分异构体A具有如下转化关系:
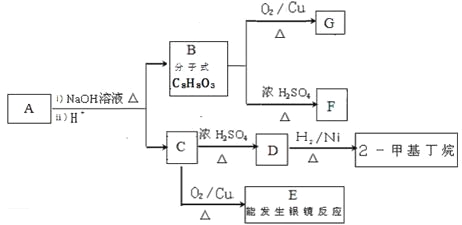
已知:
①C分子中有一个碳原子连接着4个不同的原子或原子团,且1 molC和足量金属Na反应能产生0.5 mol H2
②F中除了含有1个苯环外,还含有1个五元环
(1)写出B的结构简式___________________;写出G含有的官能团的名称_______________
(2)写出A和NaOH溶液反应的化学方程式_________________________________;
写出E发生银镜反应的化学方程式_______________________________________;
(3)B生成F的反应类型是________________;C生成D的反应类型是________________;
(4)化合物B有多种同分异构体,写出两种符合下列条件的同分异构体的结构简式:
_______________________________________________
a.属于芳香族化合物
b.酸性条件下能发生水解反应且其中一种产物的苯环上的一氯代物只有两种
c.1 mol该有机物最多可消耗3molNaOH
【答案】![]() 羧基、醛基
羧基、醛基  +NaOH
+NaOH![]()
![]() +
+
![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +H2O+2 Ag↓+3NH3 )取代反应(或酯化反应) 消去反应
+H2O+2 Ag↓+3NH3 )取代反应(或酯化反应) 消去反应 ![]()

 (写出任意两个即可)
(写出任意两个即可)
【解析】
由B可以在O2/Cu作用下氧化生成G,也可以分子内酯化生成F,推出B中含有醇羟基和-COOH,B为![]() 。1 molC和足量金属Na反应能产生0.5 mol H2,C中有一个-OH,结合合成路线图C中碳链结构与2-甲基丁烷相同,C中-OH可被氧化为醛基,C分子中有一个碳原子连接着4个不同的原子或原子团,推得C为
。1 molC和足量金属Na反应能产生0.5 mol H2,C中有一个-OH,结合合成路线图C中碳链结构与2-甲基丁烷相同,C中-OH可被氧化为醛基,C分子中有一个碳原子连接着4个不同的原子或原子团,推得C为 。由B和C知A为
。由B和C知A为 ,据以上分析解答。
,据以上分析解答。
由B可以在O2/Cu作用下氧化生成G,也可以分子内酯化生成F,推出B中含有醇羟基和-COOH,B为![]() 。1 molC和足量金属Na反应能产生0.5 mol H2,C中有一个-OH,结合合成路线图C中碳链结构与2-甲基丁烷相同,C中-OH可被氧化为醛基,C分子中有一个碳原子连接着4个不同的原子或原子团,推得C为
。1 molC和足量金属Na反应能产生0.5 mol H2,C中有一个-OH,结合合成路线图C中碳链结构与2-甲基丁烷相同,C中-OH可被氧化为醛基,C分子中有一个碳原子连接着4个不同的原子或原子团,推得C为 。由B和C知A为
。由B和C知A为 ,
,
(1)由B的结构,知G为![]() ,含有官能团为羧基、醛基;
,含有官能团为羧基、醛基;
(2)E(![]() )发生银镜反应的化学方程式
)发生银镜反应的化学方程式![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +H2O+2 Ag↓+3NH3;
+H2O+2 Ag↓+3NH3;
(3)B生成F的反应是分子内的酯化反应,属于取代反应;C生成D的反应类型是醇在浓硫酸作用下的消去反应;
(4)有题中信息a知分子中含有苯环,b知有酯基结合,c知此酯基为酚羟基与羧基形成,且有一个酚羟基;再结合酸性条件下能发生水解反应且其中一种产物的苯环上的一氯代物只有两种,可写出![]() ;
; ;
; 三种符合题意的分子。
三种符合题意的分子。

【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
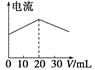
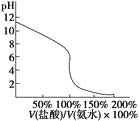
A.在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如下图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.用④滴定①,滴定曲线如下图,可用酚酞作指示剂
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)配制过程中需要用到的玻璃仪器除烧杯、玻璃棒外还需要有_________、___________。
Ⅱ.测定中和热的实验装置如下图所示。
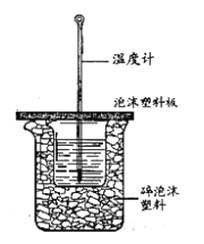
(3)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器________。
(4)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _____℃ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②通过计算可得中和热△H=___________(精确到小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是____。(填字母)
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(5)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_________(填“偏大”、“偏小”、“不受影响”)。