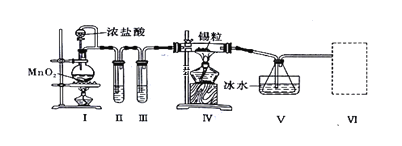
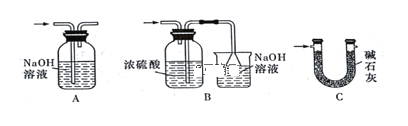
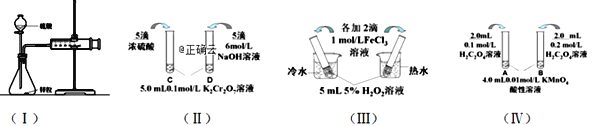
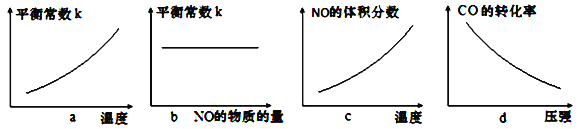
【题目】25 ℃时,部分物质的电离常数如下表所示:
化学式 | CH3COOH | H2C2O4 | H2S |
电离常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.0×10-7 Ka2=7.1×10-15 |
请回答下列问题:
(1)若把CH3COOH、H2C2O4、HC2O4-、H2S、HS- 都看作是酸,其中酸性最弱的是________。
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序为_____________________。
(3)NaHS溶液与NaHC2O4溶液反应的离子方程式为_______________。
(4)0.1 mol·L-1H2S溶液中c(H+)=________ mol·L-1。