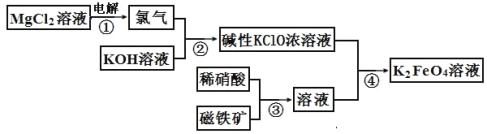
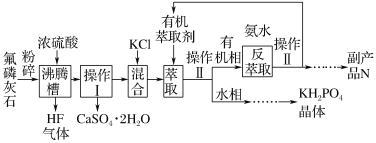
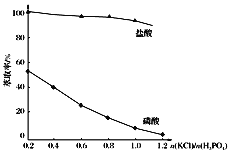
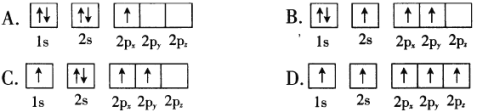
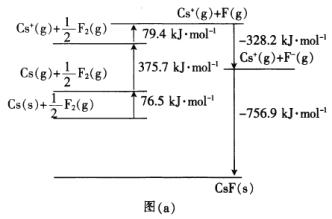
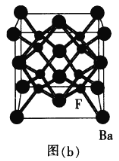
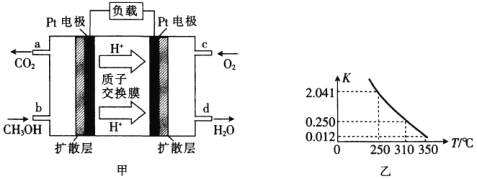
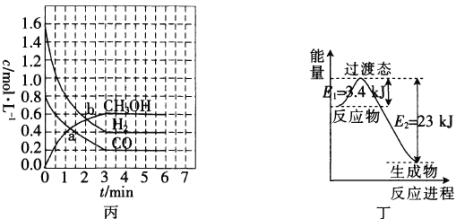
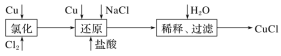
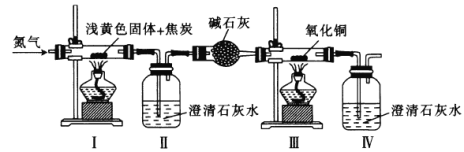
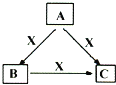
0 197514 197522 197528 197532 197538 197540 197544 197550 197552 197558 197564 197568 197570 197574 197580 197582 197588 197592 197594 197598 197600 197604 197606 197608 197609 197610 197612 197613 197614 197616 197618 197622 197624 197628 197630 197634 197640 197642 197648 197652 197654 197658 197664 197670 197672 197678 197682 197684 197690 197694 197700 197708 203614