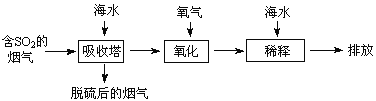
题目内容
【题目】氟的单质及含氟化合物用途非常广泛。回答下列问题:
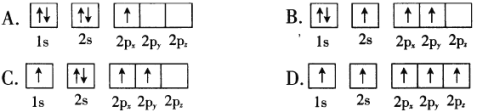
(1)BF3常用作有机反应的催化剂,下列B原子电子排布图表示的状态中,能量最低和最高的分别为____________、_______________。(填标号)
(2)NH4HF2(氟氢化铵)固态时包含的作用力有_______________(填标号)。
a.离子键 b.![]() 键 c.
键 c.![]() 键 d.氢键
键 d.氢键
(3)由反应2F2+2NaOH=OF2+2NaF+H2O可制备OF2。OF2的空间构型为___________,氧原子的杂化方式是_____________________________
(4)CsF是离子晶体,其晶格能可通过图(a)的born-Haber循环计算得到。
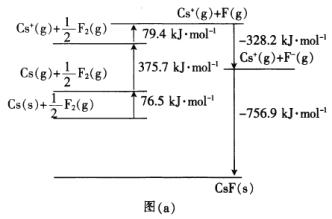
由图(a)可知,Cs原子的第一电离能为_______________________kJ·mol-1,F-F键的键能为________kJ·mol-1,CsF的晶格能为________kJ·mol-1。
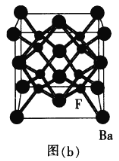
(5)BaF2晶胞是一种良好的闪烁晶体[如图(b)所示]。Ba2+的配位数为_________个;已知其密度为![]() ,则BaF2的晶胞参数为a=____________(设NA为阿伏加德罗常数的数值,列出计算式) nm。
,则BaF2的晶胞参数为a=____________(设NA为阿伏加德罗常数的数值,列出计算式) nm。
【答案】A D abd V型 sp3杂化 375.7 158.8 756.9 8 ![]()
【解析】
(1)基态B原子的排布式为1s22s22p1,处于最低能量状态,为A;B原子处于激发态时,能量较高,最高的为D;
(2)氟氢化铵固态时,铵根离子与HF2-间存在离子键,铵根离子内部N-H为![]() 键或极性共价键和配位键,H-F间为
键或极性共价键和配位键,H-F间为![]() 键,无
键,无![]() 键,氟氢化铵之间还存在氢键,答案为abd;
键,氟氢化铵之间还存在氢键,答案为abd;
(3)OF2中心O原子含有2个O-F键,2个孤电子对,为sp3杂化,空间构型为V型;
(4)Cs原子的第一电离能为气态电中性Cs原子失去一个电子转化为气态基态正离子所需要的最低能量,即Cs(g)+1/2F2(g)到Cs+(g)+1/2F2(g)的过程释放的能量,为375.7kJ/mol;F-F键的键能为Cs+(g)+1/2F2(g)到Cs+(g)+F(g)释放能量的2倍,即158.8 kJ/mol;CsF的晶格能为Cs+(g)+F-(g)到CsF(s)释放的能量为756.9kJ/mol;
(5)BaF2晶胞中,钡离子在晶胞的顶点和面心,个数为8×1/8+6×1/2=4,氟离子在内部,有8个;距离Ba2+距离相等且最近的F-在相邻的内部,个数为8,则配位数为8;ρ=m/V=(137×4+19×8)/a3×10-21×NA=4.893,则a=![]() 。
。

【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa,②0.1mol·L-1NaClO,③0.1mol·L-1Na2CO3,④0.1mol·L-1NaHCO3溶液的pH由大到小的关系为_______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为_______________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+=2HCOO-=2HCOOH+SO32-
D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(HO-)=10-ymol·L-1,x与y的关系如图所示。
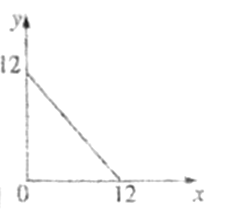
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为____________。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性,写出按乙方式混合后,反应的离子方程式:______________。按甲方式混合后,所得溶液的pH为____________。
【题目】I.下图是抚州市某儿童微量元素体检报告单的部分数据:
抚州市某医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 正常值参考范围 | |
1 | 锌(Zn) | 109.62 | μmol/L | 66-120 |
2 | 铁(Fe) | 5.92↓ | mmol/L | 7.52-11.82 |
3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
…… | ||||
根据上表的数据,回答下列问题:
(1)该儿童_____元素含量偏低。
(2)报告单中“μmol/L”是__________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的________(填“氧化性”或“还原性”)。
II. 高铁酸钾(K2FeO4,铁元素为+6价)是一种新型、高效、多功能绿色水处理剂,无二次污染。制备高铁酸钾的离子反应方程式为:___Fe(OH)3+__ClO-+___OH- = ___FeO42-+___Cl-+ __H2O
回答下列问题:
(4)配平该离子方程式。
(5)每生成1molFeO42-转移的电子数为___________,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为________mo1。