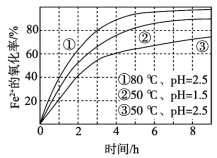
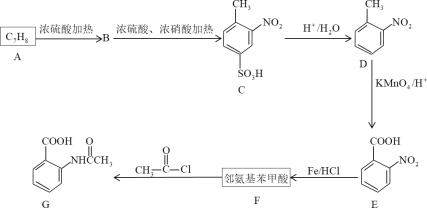
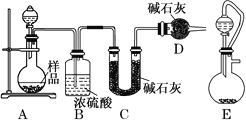
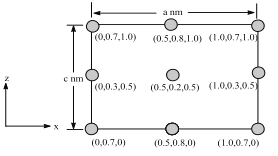
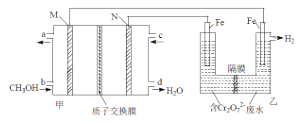
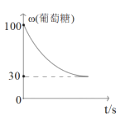
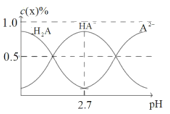
0 197132 197140 197146 197150 197156 197158 197162 197168 197170 197176 197182 197186 197188 197192 197198 197200 197206 197210 197212 197216 197218 197222 197224 197226 197227 197228 197230 197231 197232 197234 197236 197240 197242 197246 197248 197252 197258 197260 197266 197270 197272 197276 197282 197288 197290 197296 197300 197302 197308 197312 197318 197326 203614