【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为______。
2NH3(g)的化学平衡常数表达式为______。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反
应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g) + O2(g) | 5×10-31 |
② | N2(g) + 3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
① 该反应为______(填“吸热”或“放热”)反应。
② 其他条件不变时,温度升高氨的平衡含量减小的原因是______(填字母序号)。
a. 温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b. 温度升高,浓度商(Q)变大,Q > K,平衡逆向移动
c. 温度升高,活化分子数增多,反应速率加快
d. 温度升高,K变小,平衡逆向移动
③ 哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
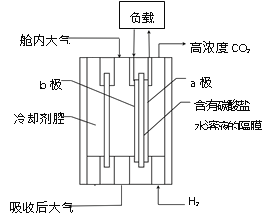
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。下图为电解法合成氨的原理示意图,阴极的电极反应式为______。
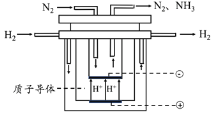
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应