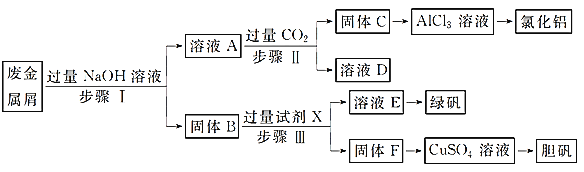
【题目】在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g) 实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
10min | 20min | 30min | 40min | 50min | 60min | |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
A. 该反应的焓变ΔH > 0,升高温度K增大
B. 300℃时,0-20 min H2的平均反应速率 v (H2)= 0.003mol/(L·min)
C. 采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D. 500℃下,向该容器中初始加入0.1 mol CO和0.3 mol H2,依据现有数据可计算反应达平衡后甲醇的浓度
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是
A. 放出热量关系:a < b <92.4
B. 三个容器内反应的平衡常数:③>①>②
C. 达平衡时氨气的体积分数:①>③
D. N2的转化率:②>①>③
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。