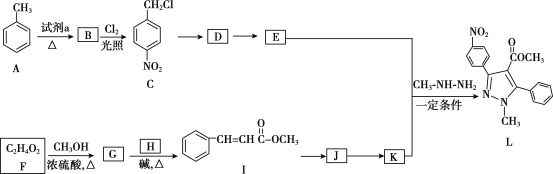
题目内容
【题目】(1)已知水在25℃和100℃时,其电离平衡曲线如图所示:

①则25℃时水的电离平衡曲线应为_____。(填“A”或“B”)
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=_____。
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=_____。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=_____。
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=_____。
(3)下列说法中正确的是_____。
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
【答案】A 1:10:10 1:10 1.0×10-15 11:9 ac
【解析】
(1)①25时水的Kw=10-14,c(H+)=10-7,由图中可确定曲线。
②三种溶液中水电离出的氢离子浓度分别为10-13、10-12、10-12,由此可求出比值。
③因为恰好中和,氢离子和氢氧根离子物质的量相等,所以Va×10-a=Vb×10-(14-b),又因为a+b=13,Va×10-a=Vb×10-(1+a),由此可求出Va:Vb。
(2)①该溶液中c(H+)=10-13,c(OH﹣)=10-2,所以Kw=c(H+)c(OH﹣)。
②根据题意可知酸过量,所以可以列出方程:Va×10-1–Vb×10-1=10-2(Va+Vb),从而求出Va:Vb。
(3)a.氢离子和氢氧根离子浓度相同,但是一水合氨是弱碱,则碱过量;
b.由图像可知100℃时Kw=c(H+)c(OH﹣)=1.0×10-12,此时pH=12的NaOH溶液中c(OH﹣)=1mol/L,比氢离子浓度大100倍;
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L,溶液可能呈酸性也可能呈碱性,而酸性溶液中NH4-和Cl-可能大量存在。
(1)①25时,水的Kw=10-14,c(H+)=10-7,可确定曲线为A。答案为:A;
②三种溶液中水电离出的氢离子浓度分别为10-13、10-12、10-12,所以比值为1:10:10。答案为:1:10:10;
③因为恰好中和,氢离子和氢氧根离子物质的量相等,所以Va×10-a=Vb×10-(14-b),又因为a+b=13,Va×10-a=Vb×10-(1+a),由此可求出Va:Vb=1:10。答案为:1:10;
(2)①该溶液中c(H+)=10-13,c(OH﹣)=10-2,所以Kw=c(H+)c(OH﹣)=1.0×10-15。答案为:1.0×10-15;
②根据题意可知酸过量,所以可以列出方程:Va×10-1–Vb×10-1=10-2(Va+Vb),从而求出Va:Vb=11:9。答案为11:9;
(3)a.氢离子和氢氧根离子浓度相同,但是一水合氨是弱碱,则碱过量,所以混合后pH>7,a正确;
b.由图像可知100℃时Kw=c(H+)c(OH﹣)=1.0×10-12,此时pH=12的NaOH溶液中c(OH﹣)=1mol/L,比氢离子浓度大100倍,等体积混合后溶液呈强碱性,pH>7,b错误;
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L,溶液可能呈酸性也可能呈碱性,而酸性溶液中NH4-和Cl-可能大量存在,c正确;故选ac。答案为:ac。

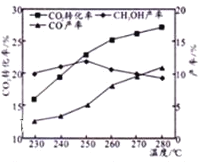
【题目】化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
化学键 | H—H | C—O | CO中的 C | H—O | C—H |
E(kJ) | m | n | E1 | x | y |
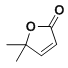
根据相关数据计算拆开1molC![]() O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: ![]()
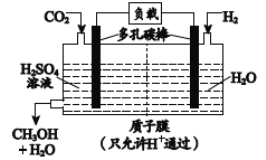
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。
【题目】现有 A、B、C、D、E、F 六种短周期主族元素,其相关性质信息如下:
元素 | 相关信息 |
A | 地壳中含量最多的金属元素 |
B | 原子核外电子数和周期序数相等 |
C | 最外层电子数是次外层电子数的 3 倍 |
D | 最高正价与最低负价代数和为 4,常温下单质为固体 |
E | 在短周期元素中,原子半径最大 |
F | M 层比L 层少 1 个电子 |
请根据上述信息,完成下列问题:
(1)请给出元素 D 在元素周期表中的位置:________。
(2)请将 A、D、E、F 四种元素的简单离子按照离子半径由大到小排序(用离子符号表示):__________。
(3)请给出化合物 BFC 的电子式:______。
(4)用电子式表示 E 与 F 形成化合物 EF 的过程:______。
(5)请将 A、D、F 三种元素的最高价氧化物对应的水化物按照酸性由强到弱排序(用化学式表示):__________。
(6)元素 A 的单质常用于野外焊接钢轨,请写出该反应的化学方程式:________。
(7)单质 A 能溶于 E 的最高价氧化物对应水化物的水溶液,请给出该反应的离子方程式:_____________。