【题目】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72和CrO42)工业废水的常用方法,过程如下:
![]()
①已知:常温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。

②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。

已知部分弱电解质的电离常数(25℃)如下:
电解质 | 电离常数 |
H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________。
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
(1)用分析天平准确称取该样品5.0 g,全部溶于水配制成1 000.0 mL的溶液。用____(填仪器名称)量取20.00 mL放在锥形瓶中,滴加几滴酚酞,待测。该中和滴定中滴定终点的现象是___。
(2)用0.10 mol·L-1稀盐酸滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | 稀盐酸的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中NaOH的质量分数为______。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果____ (填“偏高”、“偏低”或“不变”,下同);若滴定过程中不慎将锥形瓶中溶液洒出,会使所测结果_____;若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果____。
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式____;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为____,滴定终点观察到的现象为___;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3 | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为____(结果保留四位有效数字),若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会____(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001 mol·L-1CuSO4溶液中加入50mL0.00022 mol·L-1NaOH溶液, 生成了Cu (OH)2沉淀。计算沉淀生成的溶液的pH= ___(假设Cu2+被完全沉淀,混合后溶液体积不发生变化);
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入适量30% H2O2,使其充分反应;
②_______;
③过滤;
④______;
⑤过滤、洗涤、干燥;
⑥900℃煅烧。
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4kJmol-1
2CO(g)+4H2(g) △H=-71.4kJmol-1
反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJmol-1
2CO(g)+2H2(g) △H=+247.0 kJmol-1
(1)写出表示CO燃烧热的热化学方程式:_______________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
容器 | 起始物质的量(n) / mol | CO2的 平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 0 | 0 | 50% |
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_________。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(H2) = ________(用含t的表达式表示)。
③达到平衡时,容器Ⅰ、Ⅱ内CO的物质的量的关系满足:2n(CO)Ⅰ_______n(CO)Ⅱ(填“>”、“=”或“<”)
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生上述反应(i):2CH4(g)+O2(g)![]() 2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
2CO(g)+4H2(g),相同时间段内测得CO的体积分数[ψ(CO)]与温度(T)的关系如图如示。
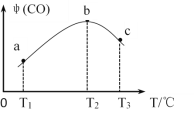
① T2℃时,CO体积分数最大的原因是_____________。
②若T2℃时,容器内起始压强为P0,平衡时CO的体积分数为20%,则反应的平衡常数KP =_______(用平衡分压强代替平衡浓度计算,分压=总压×物质的量分数)。
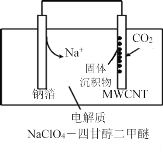
(4)2016年我国科研人员根据反应Na+CO2→ Na2CO3+C(未配平) 研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。其放电时的工作原理如图所示,已知吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面,写出放电时正极的电极反应式:_________________。
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%
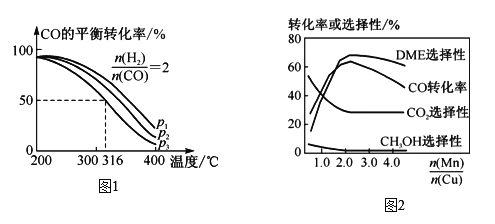
②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。

(3)在一定条件下,可发生反应6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
500K | 600K | 700K | 800K | |
n(H2)∶n(CO2)=1.5 | 45 | 33 | 20 | 12 |
n(H2)∶n(CO2)=2 | 60 | 43 | 28 | 15 |
n(H2)∶n(CO2)=3 | 83 | 62 | 37 | 22 |
根据上表中数据
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率__(填“增大”、“减小”或“不变”)。
②该反应的正反应为___热反应(填“吸”或“放”)。