题目内容
【题目】(1)用O2将HCl转化为Cl2,可提高效益、减少污染。新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
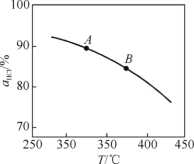
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl~T曲线如图,则总反应的ΔH__0(填“>”、“=”或“<”);A、B两点的反应速率中较大的是__。
②下列措施有利于提高αHCl的有____(填字母)。
A.增大n(HCl) B. 增大n(O2)
C. 使用更好的催化剂 D. 移去H2O
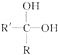
(2)乙苯催化脱氢制苯乙烯反应:![]() +H2(g),工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
+H2(g),工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1∶9),控制反应温度600 ℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图。
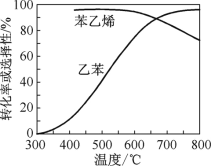
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实:_________。
②控制反应温度为600 ℃的理由是_______。
【答案】< B BD 正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积增大,平衡向正反应方向移动 600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大
【解析】
(1)①根据图像结合温度对化学反应速率与化学平衡的影响效果作答;
②改变措施有利于提高αHCl,应使平衡向正反应方向移动,注意不能只增加HCl的浓度;
(2) ①保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
②600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由。
(1)①由图可知,温度越高,平衡时HCl的转化率越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;升高温度化学反应速率增大,则A、B两点的反应速率中较大的是B,故答案为:<;B;
②A.增大n(HCl),HCl浓度增大,平衡右移,但HCl的转化率降低,A项错误;
B.增大n(O2),氧气浓度增大,平衡右移,HCl的转化率提高,B项正确;
C.使用更好的催化剂,加快反应速率,缩短到达平衡的时间,不影响平衡移动,HCl的转化率不变,C项错误;
D.移去生成物H2O,有利于平衡右移,HCl的转化率增大,D项正确,
故选:BD;
(2) ①正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
②600 ℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,乙苯的转化率较低,温度过高,苯乙烯的选择性下降,高温下催化剂可能失去活性,且消耗能量较大。
故选择600℃左右。

【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
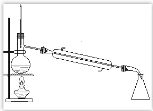
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。