【题目】氨催化氧化是硝酸工业的基础,氦气在Pt催化剂作用下发生主反应Ⅰ和副反应Ⅱ:
Ⅰ.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1=-905 kJ/mol
4NO(g)+6H2O(g) △H1=-905 kJ/mol
Ⅱ.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2
2N2(g)+6H2O(g) △H2
(1)已知:
物质中断裂1mol化学键需要的能量/kJ | NO | O2 | N2 |
629 | 496 | 942 |
则△H2=___________。
(2)以Pt为催化剂,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量与温度的关系如下图:

①该催化剂在高温时对反应__________更有利(填“Ⅰ”或“Ⅱ”)。
②520℃时,NH3的转化率为____________。
③520℃时,反应Ⅱ的平衡常数K=________(数字计算式)。
④下列说法正确的是____________(填标号)。
A 工业上氨催化氧化生成NO时,最佳温度应控制在840℃左右
B 增大NH3和O2的初始投料比可以提高NH3生成NO的平衡转化率
C 投料比不变,增加反应物的浓度可以提高NH3生成NO的平衡转化率
D 使用催化剂时,可降低反应的活化能,加快其反应速率
⑤温度高于840℃时,NO的物质的量减少的原因可能是____________。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子数为___________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂的反应器中反应。
反应相同时间NOx的去除率随反应温度的变化曲线如下图所示,在50-250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是_______________。

【题目】实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到 50~60℃反应。已知苯与硝基苯的基本物理性质如下表所示:
熔点 | 沸点 | 状态 | |
苯 | 5.51℃ | 80.1℃ | 无色液体 |
硝基苯 | 5.7℃ | 210.9℃ | 油状液体 |
(1)(在大试管中)配制浓硫酸和浓硝酸的混合酸的操作方法是____________________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是_________。
(3)某同学用如图装置制取硝基苯:
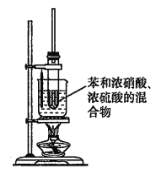
①用水浴加热的优点是________________________________________________________;
②被水浴加热的试管口部都要带一长导管,其作用是______________________________。
(4)写出此反应的化学方程式_________________________________________________。






