题目内容
【题目】加热N2O5,依次发生的分解反应为:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
A. 4.25 B. 8.5 C. 17 D. 22.5
【答案】B
【解析】在反应①中N2O3与O2 按物质的量之比1∶1生成,如果不发生反应②,则两者一样多。发生反应②,平衡后,O2比N2O3多(9-3.4)=5.6mol;反应②中每减少1mol N2O3,O2会增加1mol,即O2会比N2O3多2mol;O2比N2O3多(9-3.4)=5.6mol,则共分解了2.8mol N2O3;所以反应①中N2O5分解生成N2O3(3.4+2.8)=6.2mol,有6.2mol N2O5发生分解,所以平衡后N2O5为(8-6.2)=1.8mol。容器体积为2L,则反应①的平衡常数K=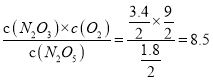 ,故选B。
,故选B。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)捕集处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料,已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g),△H1=-41.0kJmol-1,②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2=-49.0kJmol-1,③CH3OCH2(g)+H2O(g)
CO2(g)+H2(g),△H1=-41.0kJmol-1,②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2=-49.0kJmol-1,③CH3OCH2(g)+H2O(g)![]() 2CH3OH(g)△H3=+23.5kJmol-1,则反应2CO(g)+4H2(g)
2CH3OH(g)△H3=+23.5kJmol-1,则反应2CO(g)+4H2(g)![]() CH3OCH2(g)+H2O(g)的△H=______。
CH3OCH2(g)+H2O(g)的△H=______。
(2)采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如下表,依据表中数据,写出NaClO2溶液脱硝过程中发生的总反应的离子方程式:______。
离子 | NO3- | NO2- | Cl- |
c/(molL-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
(3)已知973K时,SO2与NO2反应生成SO3和NO,混合气体经冷凝分离出的SO3可用于制备硫酸。
①973K时测得:NO2(g)![]() NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)SO3(g)K3=20.则反应SO2(g)+NO2(g)
NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)SO3(g)K3=20.则反应SO2(g)+NO2(g)![]() O3(g)+NO(g)的K3=______。
O3(g)+NO(g)的K3=______。
②973K时,向体积为1L的恒容密闭容器中充入SO2、NO2各aml,平衡时SO2的转化率为______。
③恒压下SO2的分压p(SO2)随温度的变化如图所示。当温度升高时,SO2(g)+NO2(g)![]() SO2(g)+NO(g)的化学平衡常数______(填“增大”或”减小”),判断理由是______。
SO2(g)+NO(g)的化学平衡常数______(填“增大”或”减小”),判断理由是______。
(4)用纳米铁可去除污水中的NO3-,反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O;相同温度下,纳米铁粉去除不同水样中的NO3-的速率有较大差异,下表中Ⅰ和Ⅱ产生差异的原因可能是______;Ⅱ中0~20mim内用NO3-表示的平均反应速率为______molL-1min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4molL-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4molL-1(含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |


