题目内容
【题目】工业上电解精炼铜的阳极泥是重要的二次资源,从阳极泥(含铜、银、金、铅等单质)中提取金和制备AgCl的工艺如下:

已知:分金液的主要成分为H[AuCl4];分金渣的主要成分为PbSO4和AgCl;分银液的主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
回答下列问题:
(1)“分铜”时,铜单质参与反应的离子方程式为___________;如果温度过高,铜的浸出率会降低,原因是____________。
(2)“分铜渣”中的成分有Au、Ag、AgCl和__________。
(3)“分金”时,溶解单质金的化学方程式为________;除HC1、NaC1O3可溶解金外,“王水”也可溶解金,“王水”的成分为_____________(写试剂的名称)。
(4)从“分金液”中提取金时,氧化剂和还原剂的物质的量之比为_______________。
(5)向“分银液”中加入适量的H2SO4调到pH=4时“沉银”,能够析出AgCl的原因是___________。
(6)AgCl能溶于氨水,发生反应AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知
[Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知![]() =2.25)。
=2.25)。
【答案】2H++H2O2+Cu=Cu2++2H2O 温度过高时,H2O2受热分解 PbSO4 2Au+8HCl+NaClO3=2H[AuCl4]+NaCl+3H2O 浓硝酸、浓盐酸 2:3 H2SO4电离出的H+降低了SO32-的浓度,使[Ag(SO3)2]3-![]() Ag++2SO32-平衡正向移动,Ag+和Cl-反应生成AgCl 2.45
Ag++2SO32-平衡正向移动,Ag+和Cl-反应生成AgCl 2.45
【解析】
阳极泥(含铜、银、金、铅等单质)加入双氧水、硫酸和氯化钠,得到分铜液和分铜渣,这一步目的是除掉铜;分铜渣中加入盐酸和氯酸钠得到分金液(H[AuCl4])和分金渣,在分金液中加入还原剂就可以提炼出金;分金渣中加入亚硫酸钠得到分银液([Ag(SO3)2]3-)
,在分银液([Ag(SO3)2]3-)中加入硫酸,根据平衡移动原理提炼出氯化银。
(1)由于铜排在H后面,不和硫酸反应,所以需加入双氧水作为氧化剂;温度过高双氧水会分解,影响铜的浸出率;
答案: 2H++H2O+Cu=Cu2++2H2O;温度过高时,H2O2受热分解;
(2)根据后一步分金渣成分,可推测出“分铜渣”中的成分有Au、Ag、AgCl和PbSO4;
答案:PbSO4 ;
(3)根据已知分金液的主要成分为H[AuCl4],得方程式为2Au+8HCl+NaClO3=2H[AuCl4]+NaCl+3H2O;“王水”的成分为浓硝酸与浓盐酸体积比1:3混合物;
答案: 2Au+8HCl+NaClO3=2H[AuCl4]+NaCl+3H2O;浓硝酸、浓盐酸;
(4)氧化剂(H[AuCl4])中Au从正三价降到零价和还原剂(Na2SO3)中S从正四价升高到正六价,根据化合价升降相等(或得失电子数相等),可得物质的量之比为2:3;
答案: 2:3;
(5)根据化学平衡移动原理可知,H2SO4电离出的H+与SO32-,降低了SO32-的浓度,使[Ag(SO3)2]3![]() -Ag++2SO32-平衡正向移动,Ag+和Cl-反应生成AgCl,
-Ag++2SO32-平衡正向移动,Ag+和Cl-反应生成AgCl,
答案: H2SO4电离出的H+与SO32-,降低了SO32-的浓度,使[Ag(SO3)2]3![]() -Ag++2SO32-平衡正向移动,Ag+和Cl-反应生成AgCl;
-Ag++2SO32-平衡正向移动,Ag+和Cl-反应生成AgCl;
(6)根据方程式可知完全反应0.1mol AgCl,需要NH3:0.2mol,生成[Ag(NH3)2](aq))和Cl-(aq)各0.1mol,根据平衡常数计算平衡后应该还剩余的NH3,设剩余NH3 xmol,AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),由于容器体积为1L,利用物质的量代替浓度计算平衡常数K,K=2.0×10-3=
[Ag(NH3)2](aq))+Cl-(aq),由于容器体积为1L,利用物质的量代替浓度计算平衡常数K,K=2.0×10-3=![]() ,得出x=
,得出x=![]() =2.25,所以共需要NH3:0.2+2.25=2.45mol;
=2.25,所以共需要NH3:0.2+2.25=2.45mol;
答案:2.45。

 名校课堂系列答案
名校课堂系列答案【题目】实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到 50~60℃反应。已知苯与硝基苯的基本物理性质如下表所示:
熔点 | 沸点 | 状态 | |
苯 | 5.51℃ | 80.1℃ | 无色液体 |
硝基苯 | 5.7℃ | 210.9℃ | 油状液体 |
(1)(在大试管中)配制浓硫酸和浓硝酸的混合酸的操作方法是____________________。
(2)分离硝基苯和水的混合物的方法是________;分离硝基苯和苯的方法是_________。
(3)某同学用如图装置制取硝基苯:
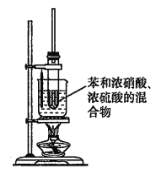
①用水浴加热的优点是________________________________________________________;
②被水浴加热的试管口部都要带一长导管,其作用是______________________________。
(4)写出此反应的化学方程式_________________________________________________。










