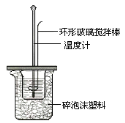
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。

主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
(1)仪器A的名称是___________。B的作用为___________。
(2)下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
(3)若将装置C改为装置D,可能会导致的后果是___________。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是______________________(用质量分数表示)。
Ⅱ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4===27H2O+10MgO+3Al2O3。
(5)写出该化合物作阻燃剂的两条依据:______________________。
(6)MgO可溶于NH4Cl的水溶液,用离子方程式表示其原理:______________________。
【题目】下列操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将等体积等浓度的HX和HY与足量的锌反应,收集产生的氢气并记录其体积 | HX收集到的氢气多 | HX是强酸 |
B | 向滴有酚酞的碳酸钠溶液中加入少量的氯化钡固体 | 红色变浅 | 碳酸钠溶液中存在水解平衡 |
C | 向反应FeCl3+3KSCN | 红色变浅 | 增大KCl的浓度,平衡逆向移动 |
D | 常温下分别测量等浓度的K2SO3和KCl溶液的pH | pH:K2SO3>KCl | 非金属性:Cl>S |
A. AB. BC. CD. D
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
a | b | ||||||||||||||||
c | d | ||||||||||||||||
e | f | g | h | i | |||||||||||||
j | k | l | m | ||||||||||||||
(1)画出k元素的原子结构示意图______________________________。
(2)写出j元素的原子核外电子排布式___________________________。
(3)写出l元素的+1价阳离子核外电子排布式___________________________。
(4)写出m元素的原子外围电子排布式___________________________,m元素位于周期表中___________周期_________族_________区。
(5)原子半径大小e___________d,第一电离能大小关系是g___________h,电负性大小关系是c___________d(以上填“>”或 “<”)。