【题目】乙醇是生活中常见的物质,用途广泛,其合成方法和性质也具有研究价值。
Ⅰ.乙醇可以作为燃料燃烧。
已知化学键的键能是指气态原子间形成1mol化学键时释放出的能量。应用表中数据(25℃、101 kPa),写出气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式_____________。
键 | C—C | C—H | O=O | H—O | C—O | C=O |
键能/(kJmol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
Ⅱ.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
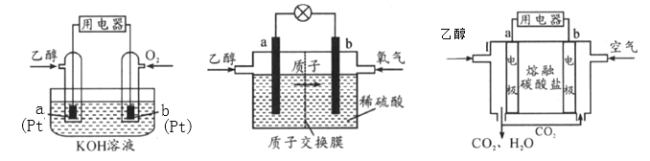
碱性乙醇燃料电池酸性乙醇燃料电池熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为_________。
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_________,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_________。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_________,通过质子交换膜的离子是_________。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_________(填“a”或“b”)移动,电极b上发生的电极反应式为_________。
Ⅲ.已知气相直接水合法可以制取乙醇:H2O(g) + C2H4(g) ![]() CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O)︰n(C2H4)=1︰1时,乙烯的平衡转化率与温度、压强的关系如下图:
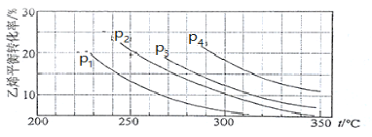
(1)图中压强P1、P2、P3、P4的大小顺序为:_________,理由是:_________。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。该条件下乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________、_________。
Ⅳ.探究乙醇与溴水是否反应。
(1)探究乙醇与溴水在一定条件下是否可以发生反应,实验如下:
实验编号 | 实验步骤 | 实验现象 |
1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
①实验2中向淀粉-KI溶液中滴加冷却后的混合液的目的是_________。
②实验3的作用是_________。
③根据实验现象得出的结论是_________。
(2)探究反应类型
现有含a mol Br2的溴水和足量的乙醇,请从定量的角度设计实验(其他无机试剂任选),探究该反应是取代反应还是氧化反应_________(已知若发生氧化反应,则Br2全部转化为HBr)。
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005mol/(L·s)。下列说法正确的是
A. 4 s时c(B)为0.38 mol/L
B. 830℃达平衡时,A的转化率为20%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为0.4
A(g)+B(g)的平衡常数为0.4
【题目】已知酸性条件下有反应:2Cu+=Cu2++Cu。氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜的红色固体产物做了如下实验,实验操作和实验现象列表如下:
加入 试剂 | 稀硫酸 | 浓硫酸 并加热 | 稀硝酸 | 浓硝酸 |
实验 现象 | 红色固体 不反应 | 无色气体 | 无色气体 蓝色溶液 | 红棕色气体 蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物( )
A. 是Cu B. 是Cu2O C. 一定有Cu,一定有Cu2O D. 一定有Cu2O,可能有Cu