题目内容
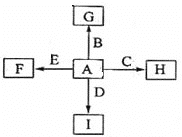
【题目】下图中,A,B,C,D,E是单质,G,H,I,F是B,C,D,E分别和A形成的二元化合物。
已知:①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
回答问题:
⑴①中反应的化学方程式为______________;
⑵化合物I的电子式为_______,它的空间结构是______;
⑶C与过量NaOH溶液反应的离子方程式为____________,反应后溶于与过量化合物I反应的离子方程式为____________________;
⑷E在I中燃烧观察到的现象是_____________________。
⑸1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量_____________;
【答案】 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3 ![]() 直线形 2Al+2OH-+2H2O=2AlO2-+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 剧烈燃烧,大量白烟,瓶壁附着有黑色物质 2Fe3++Cu=2Fe2++Cu2+ n(Fe2O3)=0.01mol,依据离子方程式得:n(Cu)=0.01mol,m(Cu)=0.64g。
直线形 2Al+2OH-+2H2O=2AlO2-+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 剧烈燃烧,大量白烟,瓶壁附着有黑色物质 2Fe3++Cu=2Fe2++Cu2+ n(Fe2O3)=0.01mol,依据离子方程式得:n(Cu)=0.01mol,m(Cu)=0.64g。
【解析】根据反应的实验现象、应用以及有关物质的性质、元素含量,结合转化关系图分析解答。
A,B,C,D,E是单质,G,H,I,F是B,C,D,E分别和A形成的二元化合物。已知:①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接,所以C是铝,B是铁,H是氧化铝,因此A是氧气。②I是一种常见的温室气体,则I是CO2,它和E可以发生反应:2E+I
B+H能放出大量的热,该反应曾应用于铁轨的焊接,所以C是铝,B是铁,H是氧化铝,因此A是氧气。②I是一种常见的温室气体,则I是CO2,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%,这说明E是镁,F是氧化镁,D是C,MgO中Mg的含量恰好是60%。根据转化关系图可知G是氧化铁。
2F+D,F中E元素的质量分数为60%,这说明E是镁,F是氧化镁,D是C,MgO中Mg的含量恰好是60%。根据转化关系图可知G是氧化铁。
⑴根据以上分析可知①中反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3;⑵化合物CO2的电子式为
2Fe+Al2O3;⑵化合物CO2的电子式为![]() ,它的空间结构是直线形;⑶铝与过量NaOH溶液反应的离子方程式为Al+2OH-+2H2O=2AlO2-+3H2↑,偏铝酸钠与足量CO2反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;⑷镁在CO2中燃烧观察到的现象是剧烈燃烧,大量白烟,瓶壁附着有黑色物质;⑸1.6g氧化铁的物质的量是 n(Fe2O3)=0.01mol,溶于盐酸,得到的溶液中铁离子的物质的量是0.02mol,与铜粉完全反应2Fe3++Cu=2Fe2++Cu2+,依据离子方程式得:n(Cu)=0.01mol,所以m(Cu)=0.01mol×64g/mol=0.64g。
,它的空间结构是直线形;⑶铝与过量NaOH溶液反应的离子方程式为Al+2OH-+2H2O=2AlO2-+3H2↑,偏铝酸钠与足量CO2反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;⑷镁在CO2中燃烧观察到的现象是剧烈燃烧,大量白烟,瓶壁附着有黑色物质;⑸1.6g氧化铁的物质的量是 n(Fe2O3)=0.01mol,溶于盐酸,得到的溶液中铁离子的物质的量是0.02mol,与铜粉完全反应2Fe3++Cu=2Fe2++Cu2+,依据离子方程式得:n(Cu)=0.01mol,所以m(Cu)=0.01mol×64g/mol=0.64g。

【题目】室温下,向100 mL 0.1 mol/L NH4Cl溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c(NH4+)=" " c(Cl-) |
B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+) = 2c(Cl-) |
C. | 100 mL H2O | 由水电离出的c(H+)c(OH-)不变 |
D. | 100 mL 0.1 mol/L NH3H2O | 溶液中 |
A. A B. B C. C D. D