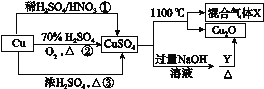
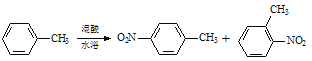
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/gcm-3 | 沸点/ ℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40 mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
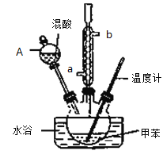
③向三颈瓶中加入混酸;
④控制水浴温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15 g。
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许 ,目的是 。
(2)冷凝管的作用是 ;冷却水从冷凝管的_______(填“a”或“b”)端进入。
(3)仪器A的名称是 ,使用该仪器前必须进行的操作是_________________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为 ,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和 、 。
(5)该实验中一硝基甲苯的产率为 (保留三位有效数字)。