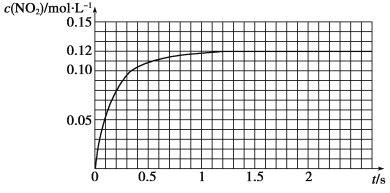
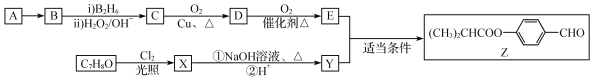
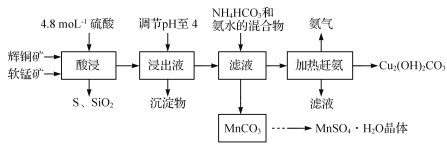
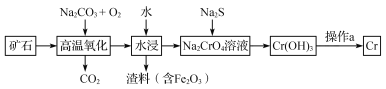
【题目】下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
烯类化合物 | 相对速率 |
(CH3)2C=CHCH3 | 10.4 |
CH3CH=CH2 | 2.03 |
CH2=CH2 | 1.00 |
CH2=CHBr | 0.04 |
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是______(填序号)。
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
请写出 与HBr反应的主要产物的结构简式_____________。
与HBr反应的主要产物的结构简式_____________。