题目内容
【题目】化学反应中的物质变化、能量变化、速率变化及反应的限度均是化学工作者研究的内容。
(1)对于基元反应(即反应物一步转化为生成物的反应)mA+nB![]() pC+qQ来说,其反应速率v=k正cm(A)cn(B)(可逆反应也存在类似的表达式),k为只与温度有关的速率常数;对于非基元反应(即不是一步完成的反应),则速率公式中的m、n就不一定均等于A、B的化学计量数,若某一物质对反应速率无影响,则其不会出现在上述公式中。
pC+qQ来说,其反应速率v=k正cm(A)cn(B)(可逆反应也存在类似的表达式),k为只与温度有关的速率常数;对于非基元反应(即不是一步完成的反应),则速率公式中的m、n就不一定均等于A、B的化学计量数,若某一物质对反应速率无影响,则其不会出现在上述公式中。
某科研小组测量反应“H2O2+2I+2H+![]() I2+H2O”的部分实验数据如下表所示
I2+H2O”的部分实验数据如下表所示
c(H2O2)/(mol·L1) | c(I)/(mol·L1) | c(H+)/(mol·L1) | I2的生成速率(mol·L1·s1) |
0.010 | 0.010 | 0.010 | 1.75 |
0.030 | 0.010 | 0.10 | 5.25 |
0.030 | 0.020 | 0.10 | 1.05 |
0.030 | 0.020 | 0.20 | 1.05 |
该反应的反应速率与浓度关系表达式为_________________,速率常数k=____________,该反应_______(填“是”或“不是”)基元反应。
(2)氮的氧化物是造成大气污染的主要成分之一,有多种方法消除氮氧化物的污染。下列 反应是消除污染的方法之一。
反应Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1
N2(g)+2CO2(g) ΔH =746 kJ·mol1
反应Ⅱ:CO(g)+NO2(g)![]() CO2(g)+ NO(g) ΔH=227 kJ·mol1
CO2(g)+ NO(g) ΔH=227 kJ·mol1
①写出CO将NO2还原为单质的热化学方程式 。
②已知C≡O的键能为1076 kJ·mol1、C=O的键能为745 kJ·mol1,则使1 mol NO2(g)、1 mol NO(g)分解成相应的原子所需要的能量之差是___________。
(3)向某密闭容器中通入等物质的量的CO、NO,在一定条件下发生如下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1。测得反应在不同温度、压强条件下,平衡混合物中CO2的体积分数如图1所示。又知该反应的逆反应速率公式为v逆=
N2(g)+2CO2(g) ΔH =746 kJ·mol1。测得反应在不同温度、压强条件下,平衡混合物中CO2的体积分数如图1所示。又知该反应的逆反应速率公式为v逆=
k逆c2(CO2)·c(N2),实验测得平衡时v逆与c(N2)的关系如图2所示。
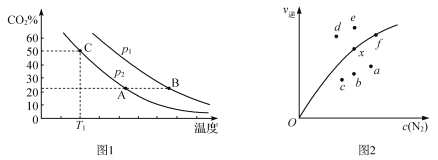
①图Ⅰ中,A、B两点对应的平衡常数K(A)_________K(B)(填“>”、“<”或“=”,下同),p1_______p2,C点所对应的反应中N2的产率是_______________。
②图Ⅱ中,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为__________。
【答案】(1)v=k正c(H2O2)c(I)(2分) 1.75![]() 102(1分) 不是(1分)
102(1分) 不是(1分)
(2) 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH =1200 kJ·mol1(2分) 187 kJ (2分)
N2(g)+4CO2(g) ΔH =1200 kJ·mol1(2分) 187 kJ (2分)
(3)>(1分) >(1分) 80%(2分) d(2分)
【解析】 (1)由表中数据知其它成分浓度不变时,生成I2的速率与c(H2O2)、c(H+)大小均成正 比但 与c(H+)大小无关,故有v=k正c(H2O2)c(I),将有关数据代入表达式中可得k=1.75![]() 102;对于该反应,速率公式中的m、n不等于对应的化学计量数,即不是基元反应,故该反应不是一步完成的。
102;对于该反应,速率公式中的m、n不等于对应的化学计量数,即不是基元反应,故该反应不是一步完成的。
(2)用Ⅰ式+2![]() II式即可得到4CO(g)+2NO2(g)
II式即可得到4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ΔH = 1200 kJ·mol1;由反 应Ⅱ可得:E(NO2)+E(C≡O)E(NO)2E(C=O)=227 kJ,代入键能数据可求出NO2、NO的键能 差为:E(NO2) E(NO)=187 kJ。
N2(g)+4CO2(g) ΔH = 1200 kJ·mol1;由反 应Ⅱ可得:E(NO2)+E(C≡O)E(NO)2E(C=O)=227 kJ,代入键能数据可求出NO2、NO的键能 差为:E(NO2) E(NO)=187 kJ。
(3)①该反应是放热反应,温度越高,化学平衡常数K越小;由图像知B点温度高,故K(A)>K(B)。又温度一定时,压强越大,越有利于平衡向右进行,CO的体积分数越大,故p1>p2。
2CO(g)+ 2NO(g)![]() N2(g)+ 2CO2(g)
N2(g)+ 2CO2(g)
开始时物质的量(mol) 1 1 0 0
变化的物质的量(mol) x x 0.5x x
平衡时物质的量(mol) 1x 1x 0.5x x
x/(20.5x)=50%,x=0.8,CO2 的理论产量是0.5 mol,故产率为80%。
②温度升高平衡向左移动,导致c(N2)减小,但升高温度后反应速率加快,故对应状态为d。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案