0 13978 13986 13992 13996 14002 14004 14008 14014 14016 14022 14028 14032 14034 14038 14044 14046 14052 14056 14058 14062 14064 14068 14070 14072 14073 14074 14076 14077 14078 14080 14082 14086 14088 14092 14094 14098 14104 14106 14112 14116 14118 14122 14128 14134 14136 14142 14146 14148 14154 14158 14164 14172 203614




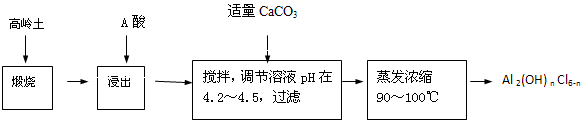
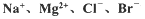 等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: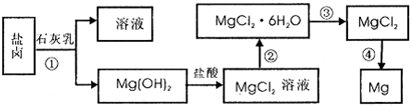

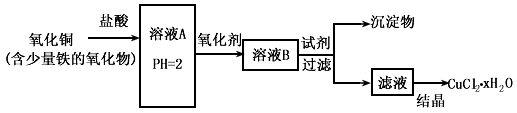
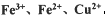 。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同)
。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同) 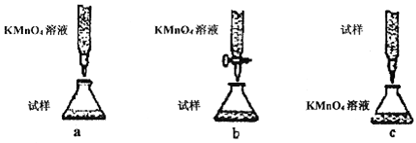



 C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。试回答下列问题。
C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。试回答下列问题。 


