0 11786 11794 11800 11804 11810 11812 11816 11822 11824 11830 11836 11840 11842 11846 11852 11854 11860 11864 11866 11870 11872 11876 11878 11880 11881 11882 11884 11885 11886 11888 11890 11894 11896 11900 11902 11906 11912 11914 11920 11924 11926 11930 11936 11942 11944 11950 11954 11956 11962 11966 11972 11980 203614
 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题 
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)  _____
_____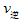 (填“>”“<”或“=”)
(填“>”“<”或“=”)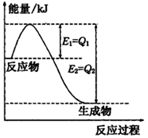


 2HI(g)达平衡后,改变平衡混合物浓度,平衡一定移动
2HI(g)达平衡后,改变平衡混合物浓度,平衡一定移动  )在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题
)在工业生产中的大量运用,满足了人口的急剧增长对粮食的需求,也为化工生产提供了足够的原料。按要求回答下列问题


