题目内容
15.将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,则溶液中H+的浓度与通入的Cl2的物质的量的关系是下列图中的(纵坐标都表示H+的物质的量浓度( )| A. | 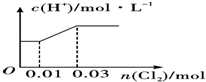 | B. |  | ||
| C. |  | D. |  |
分析 还原性H2SO3>HBr,所以向混合溶液中通入氯气时,先氧化H2SO3后氧化HBr,根据方程式H2SO3+Cl2+H2O═2HCl+H2SO4知,0.02mol H2SO3完全被氧化,需要n(Cl2)=n(H2SO3)=0.02mol,
亚硫酸是弱酸、盐酸和硫酸都是强酸,所以随着反应的进行氢离子浓度增大;
剩余的0.01mol氯气氧化HBr,根据Cl2+2HBr=Br2+2HCl知,0.01mol氯气能氧化0.02molHBr,HCl、HBr都是强电解质,溶液中c(H+)不变,以此解答该题.
解答 解:因还原性H2SO3>HBr,所以向混合溶液中通入氯气时,先氧化H2SO3后氧化HBr,根据方程式H2SO3+Cl2+H2O═2HCl+H2SO4知,0.02mol H2SO3完全被氧化,需要n(Cl2)=n(H2SO3)=0.02mol,亚硫酸是弱酸、盐酸和硫酸都是强酸,所以随着反应的进行氢离子浓度增大;
剩余的0.01mol氯气氧化HBr,根据Cl2+2HBr=Br2+2HCl知,0.01mol氯气能氧化0.02molHBr,HCl、HBr都是强电解质,所以该过程中氢离子浓度不变,即横坐标增大而纵坐标不变,
故选B.
点评 本题以物质之间的反应为载体考查氧化还原反应的计算、强弱电解质等知识点,侧重考查学生的分析、计算能力,明确方程式中各个物理量之间的关系是解本题关键,注意氯气和HBr反应时氢离子浓度不变,为易错点.

练习册系列答案
相关题目
12.医学研究证明用放射性13653I治疗肿瘤可收到一定疗效,下列有关I叙述正确的是( )
| A. | 13653I是碘的一种同素异形体 | |
| B. | 13653I是一种新发现的元素 | |
| C. | 它的中子数是53 | |
| D. | 核内的中子数与核外电子数之差为30 |
20.在下列反应中,生成物的能量总和高于反应物的能量总和的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)放热反应 | |
| B. | 2CO(g)+O2(g)═2CO2(g) 放热反应 | |
| C. | CaCO3(s)═CaO(s)+CO2(g)吸热反应 | |
| D. | H+(aq)+OH-(aq)═H2O(l)放热反应 |
7.下列有关物质的性质和应用均正确的是( )
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | Fe在O2中的燃烧产物可用于制红色涂料 | |
| C. | 瓷坩埚能耐高温,可用于加热熔化烧碱、纯碱等固体 | |
| D. | Mg (OH)2分解吸热且生成高熔点固体,可用作阻燃剂 |
4.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.lmolN5+离子中所含的电子数为3.4 NA | |
| C. | 2mol金属铝与足量的盐酸反应,共失去了4NA个电子 | |
| D. | 16 g氧气和16 g臭氧所含的原子数均为0.5NA |