题目内容
9.下列推断正确的是( )| A. | 由H+(aq)+OH-(aq)=H20(1)△H=-57.3 kJ•mol-1,可知含1 mo1 HCl的溶液与1 mol NaOH固体混合,放出热量大于57.3 kJ | |
| B. | 由C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1,可知石墨没有金刚石稳定 | |
| C. | 由N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ | |
| D. | 由△G=△H-T△S可知,所有的放热反应都能自发进行 |
分析 A、NaOH固体溶于水要放热;
B、物质具有的能量越低越稳定;
C、N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1的意义是1 mol N2(g)和3 mol H2(g)完全转化为氨气放出热量为:92.4 kJ,而氮气和氢气不可能完全转化;
D、反应自发进行由焓变、熵变、温度共同决定.
解答 解:A.NaOH固体溶于水要放热,放出热量大于57.3 kJ,故A正确;
B.从C(石墨)═C(金刚石)△H=+1.9kJ/mol,可知石墨具有的能量较低,物质具有的能量越低越稳定,所以石墨比金刚石更稳定,故B错误;
C.已知N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1,将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应,该反应为可逆反应,氮气和氢气不能全部转化为氨气,则实际反应的氮气的物质的量小于1mol,则放出的热量小于92.4 kJ,故C错误;
D、反应自发进行由△G=△H-T△S<0确定,可知,放热反应△H<0,若高温下,△S<0,可能存在△G=△H-T△S>0,所以不是所有放热反应都能自发进行,故D错误;
故选A.
点评 本题考查了反应能量变化分析判断,中和热判断,反应自发进行的依据,可逆反应的应用,题目难度中等.

练习册系列答案
相关题目
5.在碱性溶液中能大量共存的离子组是( )
| A. | K+、Fe2+、NO3-、Cl- | B. | Na+、SO42-、Ba2+、H+ | ||
| C. | Na+、CO32-、Cl-、NO3- | D. | Al3+、K+、Cl-、SO42- |
20.下列关于Na的叙述中,不正确的是( )
| A. | Na原子最外层有1个电子,易失去,是活泼的金属元素 | |
| B. | Na原子失去1个电子,Al原子能失去3个电子,说明Na的还原性比Al弱 | |
| C. | Na与氧气反应,在不同的条件下生成不同的产物 | |
| D. | Na在空气中会发生变化,要保存在煤油中,以隔绝空气 |
17.下列说法正确的是( )
| A. | 物质的粒子数可用摩尔这一物理量来计量 | |
| B. | 阿伏加德罗常数个粒子的质量(g)与该粒子的摩尔质量(g/mol)在数值上相等 | |
| C. | 1 L氧气与1L二氧化碳气体含有相同数目的分子 | |
| D. | 40gNaOH溶于1L水,配得1 mol/LNaOH溶液 |
4.利用右图所示装置进行下列实验,试管②中一定观察不到的现象是( )
| 选项 | a | b | c | 试管②中现象 | 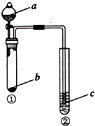 |
| A | NaOH溶液 | 铝 | 肥皂水 | 肥皂泡可点燃 | |
| B | 浓硫酸 | Na2SO3 | Na2SiO3溶液 | 生成白色胶状沉淀 | |
| C | 浓硫酸 | 铜 | 品红溶液 | 溶液红色褪去 | |
| D | 水 | Na2O2 | 酸化的KI溶液 | 溶液变黄 |
| A. | A | B. | B | C. | C | D. | D |
14.据报导,在全国各地发生过多次因混合清洁剂引起氯气中毒的事件.据此推测相混合的清洁剂中最有可能含( )
| A. | ClO4-、Cl-、Na+ | B. | ClO-、Cl-、H+ | C. | NaClO、NaClO3 | D. | NaClO、NaCl |
1.下列叙述不正确的是( )
| A. | 12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为62 g/mol | |
| B. | 同温、同压、同体积的H2和A2气体的质量分别是0.2g和3.2g,则A的相对原子质量为16 | |
| C. | 在标准状况下,CO和CO2混合气体共33.6 L,质量为50g,则两种气体的物质的量之比为1:1 | |
| D. | 浓盐酸的质量分数为36.5%,密度为1.19g•cm-3,则物质的量浓度是11.9 mol•L-1 |
18.含磷洗涤剂主要是添加了三聚磷酸钠,禁止使用含磷洗涤剂的原因是( )
| A. | 会引起白色污染 | B. | 会使水生植物大量繁殖,水质变坏 | ||
| C. | 会使水中形成沉淀堵塞下水管道 | D. | 价格昂贵,使用成本高 |
19.某溶液中含有大量的NH4+、C1-、Ca2+,在该溶液中还可能大量存在的离子是( )
| A. | CO32- | B. | OH- | C. | Al3+ | D. | Ag+ |