题目内容
在同一溶液中,含有NH4+、I-、Ba2+、Cl-等离子,则该溶液可能的pH和介质是( )
| A、pH=1 盐酸为介质 |
| B、pH=3 硫酸为介质 |
| C、pH=5 次氯酸为介质 |
| D、pH=12 氢氧化钠为介质 |
考点:离子共存问题
专题:离子反应专题
分析:溶液中存在弱碱根离子铵离子,铵离子水解显示酸性,溶液的pH<7;碘离子具有还原性,不能存在具有强氧化性的次氯酸;溶液中存在钡离子,溶液中不会存在硫酸根离子,所以不可能为硫酸,据此进行解答.
解答:
解:溶液中存在NH4+,NH4+水解后溶液显示酸性,所以溶液的pH小于7,所以D错误;
溶液中存在具有还原性的I-,所以溶液中不会存在具有强氧化性的物质,如次氯酸,故C错误;
溶液中存在Ba2+,一定不存在硫酸根离子,所以一定不存在硫酸为介质,故B错误;
所以只有A正确,
故选A.
溶液中存在具有还原性的I-,所以溶液中不会存在具有强氧化性的物质,如次氯酸,故C错误;
溶液中存在Ba2+,一定不存在硫酸根离子,所以一定不存在硫酸为介质,故B错误;
所以只有A正确,
故选A.
点评:本题考查了离子反应与离子共存,题目难度中等,注意掌握常见的离子之间的反应及离子共存的条件,明确能够发生氧化还原反应的离子之间也不能共存.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于化学与生活的认识不正确的是( )
| A、CaO能与SO2反应,CaO可作工业废气的脱硫剂 |
| B、同浓度的Na2CO3溶液在不同温度下的去污能力不同 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A、80mL 10mol?L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
| B、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| C、1molA13+含有核外电子数为3NA |
| D、常温下,16gCH4中共用电子对的数目为4NA |
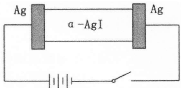 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |
下列各组离子在指定的溶液中一定能大量共存的是( )
| A、碱性溶液中:K+、Ba2+、Cl-、NO3- |
| B、酸性溶液中:Na+、Fe2+、NO3-、SO42- |
| C、能与Al反应生成H2的溶液:Mg2+、K+、NO3-、Cl- |
| D、澄清透明溶液中:Na+、H+、AlO2-、MnO4- |
下列各溶液中,物质的量浓度关系正确的是( )
| A、0.1mol?L-1的KA1(SO4)2溶液中:c(SO42-)>c(K+)>c(A13+)>c(H+)>c(OH-) |
| B、10mL 0.01mo1?L-1HCl溶液与10mL 0.01mo1?L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C、在0.1mol?L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
 科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下: 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.

