题目内容
2.有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍;M的单质是一种有色气体,可用于自来水的消毒;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多.下列说法正确的是( )| A. | X有两种常见氧化物,所含的化学键类型完全相同 | |
| B. | N与M形成的化合物的水溶液显酸性 | |
| C. | 离子半径:N>X,Y>M | |
| D. | 气态氢化物的稳定性:Y>M |
分析 有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.
解答 解:有四种短周期元素(除稀有气体之外)X、Y、M、N,其中X是短周期中金属性最强的元素,则X为Na;Y原子的最外层电子数是最内层电子数的3倍,是电子层数的2倍,最外层电子数为6,原子有3个电子层,则Y为S元素;M的单质是一种有色气体,可用于自来水的消毒,则M为Cl;N的最高价氧化物对应的水化物是药物胃舒平的有效成分,该药物用于治疗胃酸过多,则N为Al.
A.X两种常见氧化物有氧化钠、过氧化钠,氧化钠只含有离子键,过氧化钠含有离子键、共价键,故A错误;
B.N与M形成的化合物为氯化铝,铝离子水解,溶液呈酸性,故B正确;
C.电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:N(Al3+)<(Na+),Y(S2-)>(Cl-),故C错误;
D.非金属性Y(S)<M(Cl),故气态氢化物的稳定性:Y<M,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
12.想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液体)这三种物质为什么可以归为一类,下列哪些物质可以和它们归为一类( )
| A. | 75%的酒精溶液 | B. | 硝酸钠 | C. | 碱石灰 | D. | 豆浆 | ||||
| E. | 过氧化钠 |
10.下列分子中含有两个π键的组合是( )
①H2O ②CO2 ③H-C≡N ④NH3 ⑤N2 ⑥CH4.
①H2O ②CO2 ③H-C≡N ④NH3 ⑤N2 ⑥CH4.
| A. | ①③⑥ | B. | ②③⑤ | C. | ①②③⑥ | D. | ③④⑤⑥ |
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 60g二氧化硅晶体中含有2NA个硅氧键 | |
| B. | 1molD2O中含有10NA个质子 | |
| C. | 12g金刚石中含有NA个碳碳键 | |
| D. | 1mol石墨晶体中含有2NA个碳碳键 |
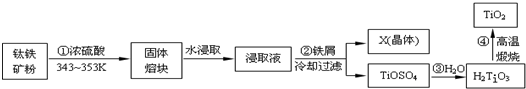
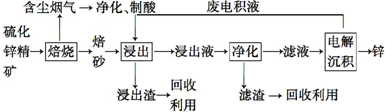
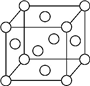 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题: