题目内容
11.科学家从蛋白质的水解液中分离出一种分子中只含1个氮原子的氨基酸,进行分析时,从1.995g该氨基酸中得到168mL(标准状况)的氮气;另取26.6g该氨基酸恰好与1.6molL -1250mL的NaOH溶液完全反应.(1)求该氨基酸的摩尔质量.
(2)试确定此氨基酸的结构简式.
分析 (1)n(N2)=$\frac{0.168L}{22.4L/mol}$=0.0075mol,根据N原子守恒知,n(氨基酸)=2n(N2)=0.0075mol×2=0.015mol,其摩尔质量M=$\frac{m}{n}$=$\frac{1.995g}{0.015mol}$=133g/mol;
(2)26.6g该氨基酸物质的量=$\frac{26.6g}{133g/mol}$=0.2mol,n(NaOH)=1.6mol/L×0.25L=0.4mol,则氨基酸和氢氧化钠的物质的量之比=0.2mol:0.4mol=1:2,说明氨基酸中含有两个羧基,结合相对分子质量判断其结构简式.
解答 解:(1)n(N2)=$\frac{0.168L}{22.4L/mol}$=0.0075mol,根据N原子守恒知,n(氨基酸)=2n(N2)=0.0075mol×2=0.015mol,其摩尔质量M=$\frac{m}{n}$=$\frac{1.995g}{0.015mol}$=133g/mol,
答:其摩尔质量是133 g•mol-1;
(2 )26.6g该氨基酸物质的量=$\frac{26.6g}{133g/mol}$=0.2mol,n(NaOH)=1.6mol/L×0.25L=0.4mol,则氨基酸和氢氧化钠的物质的量之比=0.2mol:0.4mol=1:2,说明氨基酸中含有两个羧基,该氨基酸中还含有一个氨基,则还有C原子个数=$\frac{133-16-45×2}{12}$=2…3,所以还含有2个C原子、3个H原子,其结构简式为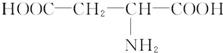 ,
,
答:其结构简式为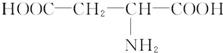 .
.
点评 本题考查根据化学方程式有关计算,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意C原子个数计算方法,题目难度不大.

| A. |  +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$ +HCl +HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$ 2CH3CHO+2H2O | |
| C. | ClCH2CH=CH2+NaOH $→_{△}^{H_{2}O}$ HOCH2CH=CH2+NaCl | |
| D. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ +H2O +H2O |
| 实验操作 | 实验目的 | |
| A | C2H4与C2H6混合气体通过盛有酸性KMnO4的洗气瓶 | 除去C2H6中的C2H4 |
| B | 制溴苯时用Fe | 加快化学反应速率 |
| C | 淀粉溶液水解后冷却至室温,加碘水观察现象 | 检验淀粉是否完全水解 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,先加稀硝酸,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氕和氘 | B. | 蓝矾和胆矾 | C. | 金刚石和石墨 | D. | 丁烷和异丁烷 |
| A. | Fe3O4可做红色颜料 | B. | Fe(OH)2在空气中易被氧化 | ||
| C. | Fe3+的盐溶液遇KSCN溶液显红色 | D. | 钢铁是用量最大、用途最广的合金 |
| A. | 配制银氨溶液:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| B. | 用惰性电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 溴乙酸与氢氧化钠溶液共热:BrCH2COOH+OH-$\stackrel{△}{→}$BrCH2COO-+H2O | |
| D. | 向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| A. | 28g N2所含的原子数目为NA | |
| B. | 标准状况下,18 g H2O所占的体积约为22.4 L | |
| C. | 0.5 mol H2SO4含有的原子数目为3.5NA | |
| D. | 在常温常压下,11.2 L N2含有的原子数为NA |

 .
. .
. .①含有苯环,且苯环上的一元取代物只有一种
.①含有苯环,且苯环上的一元取代物只有一种 . (已知:CH2═CHCH3$→_{Cl_{2}}^{光照}$CH2═CHCH2Cl)
. (已知:CH2═CHCH3$→_{Cl_{2}}^{光照}$CH2═CHCH2Cl)