题目内容
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
下列说法正确的是( )
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:Y>X |
| D.X、Z形成的化合物中可能含有共价键 |
CD
解析试题分析:A、X和R最外层电子数相同,在一个主族;B、X 和Y在第二周期,W、R、Z在第三周期,
原子半径:R>W>X;C、非金属性越强,氢化物稳定,所以,C正确;D.X、Z形成的化合物为过氧化钠,既有离子键又有非极性共价键。
考点:考查元素周期律。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是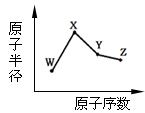
| A.对应简单离子半径:X>W |
| B.对应气态氢化物的稳定性Y>Z |
| C.化合物XZW既含离子键,又含共价键 |
| D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应 |
不能通过化学反应实现的是
| A.生成一种新离子 | B.生成一种新分子 |
| C.生成一种新原子 | D.生成一种新物质 |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
| A.Z与Y形成的化合物可作为耐高温材料 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.原子半径按X、Y、Z、R、W的顺序依次增大 |
| D.熔沸点:X2R>X2Y |
元素周期表中同周期或同主族元素,随着原子序数的递增,下列说法正确的是
| A.ⅦA族元素的单质沸点逐渐降低 |
| B.ⅥA族元素的原子核外最外层电子数逐渐增多 |
| C.碱金属元素最高价氧化物的水化物碱性逐渐增强 |
| D.第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
下列有关元素的性质及其递变规律正确的是
| A.Ⅰ A族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B.第二周期元素从左到右,最高正价从+1递增到+7,最低负价从—4升高到—1 |
| C.同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D.同周期主族金属元素的化合价越高,其原子失电子能力越强 |
根据中学化学教材所附元素周期表判断,下列叙述正确的是
| A.L电子层电子数为奇数的所有元素都是非金属 |
| B.第3、4、5、6周期元素的数目分别是8、18、32、32 |
| C.由左至右第8、9、10三列元素中没有非金属元素 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
在2p能级上最多只能排布6个电子,其依据的规律是
| A.能量最低原理 | B.泡利不相容原理 |
| C.洪特规则 | D.能量最低原理和泡利不相容原理 |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.R氢化物的沸点高于Y氢化物的沸点 |
| B.R元素基态原子与W元素基态原子未成对电子数相同 |
| C.W与Y形成的化合物能与强碱溶液反应,但不能与任何酸反应 |
| D.R与Y形成的化合物和W与Y形成的化合物的晶体类型相同 |