题目内容
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是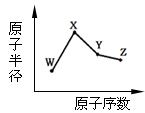
| A.对应简单离子半径:X>W |
| B.对应气态氢化物的稳定性Y>Z |
| C.化合物XZW既含离子键,又含共价键 |
| D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应 |
C
解析试题分析:W、X、Y、Z分别为O、Na、Si、Cl,其中 X和Ne原子的核外电子数相差1为F或Na,但其半径比W大,故为钠。A、氧离子与钠离子核外电子数同,但氧离子质子数少,半径大,正确;B、非金属性Si弱于Cl,氢化物同样,错误;C、该物质为NaClO,含有离子键和共价键,正确;D、二氧化硅为 酸性氧化物不与盐酸反应,错误。
考点:考查元素周期律有关问题。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
两种短周期元素X和Y形成的单质能与氢气反应生成HX和HY,反应热分别为Q1和Q2,已知Q1>Q2,,则判断一定正确的是
| A.沸点:HY>HX | B.还原性:HY>HX |
| C.稳定性:HY>HX | D.酸性:HXO4>HYO4 |
“嫦娥三号”,携带的“玉兔号”月球车使用的耐压外壳为钛合金。某种超高硬度钛合金的成分为Ti—6.5A1—6V一4Cr—0.5Si,该钛合金中硅元素在周期表中的位置为
| A.第三周期ⅣA族 | B.第三周期ⅢA族 |
| C.第四周期ⅣA族 | D.第四周期ⅣB族 |
X、Y、Z、M、N代表五种金属,有以下化学反应:
①水溶液中:X+Y2+=X2++Y;
②Z+2H2O(冷)=Z(OH)2+H2↑;
③M、N为电极与N盐溶液组成原电池,负极反应为:M-2e-=M2+;
④Y可以溶于稀H2SO4中,M不能被H2SO4氧化,则这五种金属的活动性由弱到强的顺序是
| A.M<N<Y<X<Z | B.N<M<Y<X<Z |
| C.N<M<X<Y<Z | D.X<Z<N<M<Y |
X、Y、Z三种短周期元素在周期表中的位置如图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是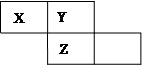
| A.气态氢化物的沸点:Z<Y |
| B.Z元素的氧化物对应的水化物一定是一种强酸 |
| C.三种元素原子半径的大小顺序为: X>Y>Z |
| D.Z单质与Fe反应生成的化合物中,铁元素显+3价 |
下列说法错误的是
| A.同主族元素的简单阴离子还原性越强,水解程度越大 |
| B.Na和Cs属于IA族元素,Cs失电子的能力比Na强 |
| C.IA族与VIIA族元素间可形成共价化合物或离子化合物 |
| D.同周期元素(0族元素除外)从左到右,原子半径逐渐减小 |
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
下列说法正确的是( )
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:Y>X |
| D.X、Z形成的化合物中可能含有共价键 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/10-12 m | 160 | 110 | 70 | 66 |
| 主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
下列叙述正确的是 ( )。
A.离子半径:W<X
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
 ,则该元素在周期表中位于第三周期、ⅥA族
,则该元素在周期表中位于第三周期、ⅥA族
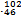 Pd和
Pd和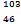 Pd互为同位素
Pd互为同位素