题目内容
15. 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | bc段与cd段所消耗CO2的体积相同 | |
| C. | bc段反应的离子方程式是2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| D. | de段沉淀减少是由于BaCO3固体的消失 |
分析 只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=Ba CO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生CO32-+CO2+H2O=2HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,以此来解答.
解答 解:只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=Ba CO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生CO32-+CO2+H2O=2HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,
A.由上述分析可知,Oa发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,故A正确;
B.由上述分析可知,ab段发生:2OH-+CO2═CO32-+H2O,bc段发生:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,cd段发生:CO32-+CO2+H2O=HCO3-,de段发生:BaCO3+CO2+H2O=Ba2++2HCO3-,bc段与cd段两阶段所消耗CO2的体积不一定相同,故B错误;
C.由上述分析可知,bc段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,故C正确;
D.由上述分析可知,de段发生反应BaCO3+CO2+H2O=Ba(HCO3)2,导致沉淀的减少,故D正确;
故选B.
点评 本题以图象题形式考查反应先后顺序问题,为高频考点,侧重对基础知识的综合考查,把握元素化合物性质及发生的反应、图象与反应的对应关系是关键的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 20 | 2 | 1 | 37 |
| 反应后质量(g) | 未测 | 32 | 1 | 12 |
| A. | 物质Z可能是该反应的催化剂 | B. | 反应后物质X的质量为15g | ||
| C. | 反应中Y、Q的质量比为6:5 | D. | 物质Y一定是单质 |
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若有pH=7,则消耗溶液的体积:②<③ | |
| C. | 将①、④混合,若有c(CH3COO-)>c(H+),则c(OH-)>c(Na+) | |
| D. | 将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② |
| A. | K=$\frac{c(C{O}_{3}^{2-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$ | B. | K=$\frac{c(C{O}_{3}^{2-}){c}^{2}({H}^{+})}{c({H}_{2}C{O}_{3})}$ | ||
| C. | K1=$\frac{c(HC{O}_{3}^{-})c({H}^{+})}{c({H}_{2}C{O}_{3})}$ | D. | K2=$\frac{(C{O}_{3}^{2-})c({H}^{+})}{c(HC{O}_{3}^{-})}$ |





 .
. 生成A的化学方程式为
生成A的化学方程式为 +HCHO.
+HCHO. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.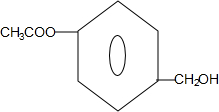 (任写一种结构简式).
(任写一种结构简式).