题目内容
4.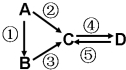 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物.D物质常用于食品工业.写出④反应的化学方程式NaOH+CO2=NaHCO3.
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.写出③反应的化学方程式4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O.
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出④反应离子方程式AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式Si+2NaOH+H2O=Na2SiO3+2H2↑.
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.写出④反应的离子方程式2Fe3++Fe=3Fe2+.
分析 (1)若B是淡黄色固体,②③反应均用到同一种液态氢化物,应为水,则A为Na,B为Na2O2,所以C为NaOH,D物质常用于食品工业,则D为NaHCO3;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2,B为NH3,氨气能被氧化成NO,所以C为NO,D为NO2,A是单质,则A为N2,依据推断出的物质书写化学方程式;
(3)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,单质A为Al,依据推断出的物质判断;
(4)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;
(5)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,推断A为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2.
解答 解:(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物,应为水,则A为Na,B为Na2O2,所以C为NaOH,D物质常用于食品工业,则D为NaHCO3,反应④的化学方程式为NaOH+CO2=NaHCO3,
故答案为:NaOH+CO2=NaHCO3;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2,B为NH3,氨气能被氧化成NO,所以C为NO,D为NO2,A是单质,则A为N2,③反应的化学方程式为4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O;
(3)若D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸钠NaAlO2,②③反应均要用强碱溶液,判断A为Al,B为AlCl3,单质A为Al,元素在周期表中的位置是第三周期ⅢA族,④反应离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(4)若A是太阳能电池用的光伏材料,判断A为Si.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性,说明盐水解呈碱性,C为Na2SiO3,D为Na2CO3,B为SiO2;反应②的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(5)若A是应用最广泛的金属.推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质.推断为Cl2,C的溶液用于蚀刻印刷铜电路板,判断C为FeCl3,D为FeCl2,④反应的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查了物质转化关系的应用和性质应用,主要考查硫及其化合物性质、氮及其化合物、硅及其化合物、铁及其化合物性质的综合应用,用好条件是解题关键.

 阅读快车系列答案
阅读快车系列答案| A. | 铝热法冶炼难熔金属 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | Na2O2用作呼吸面具的供氧剂 | D. | 工业上电解熔融状态Al2O3制备Al |
| A. | 甲烷分子是由非极性键构成的分子 | |
| B. | 甲烷分子具有正四面体结构 | |
| C. | 甲烷分子中四个C-H键是完全相同的键 | |
| D. | 甲烷分子和CCl4分子具有相同的空间结构 |
| A. | 21:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
| A. |  配制溶液 | B. |  分离乙醇和水 | ||
| C. |  除去CO气体中的CO2 | D. |  除去粗盐中的不溶物 |
| A. | 氢氧化钠 | B. | 碱石灰 | C. | 氧化钙 | D. | 浓H2SO4 |

| A. | 可以用酒精从该碘盐配制的溶液中萃取KIO3 | |
| B. | “烹调时待食品熟后加入碘盐”的原因可能是碘酸钾受热易分解 | |
| C. | 1 kg此食盐中含碘酸钾(35±15)mg | |
| D. | 食用加碘盐的目的是预防龋齿 |
| A. | I2+SO2+2H2O═H2SO4+2HI | B. | 2FeCl2+Cl2═2FeCl3 | ||
| C. | 2FeCl3+2HI═2FeCl2+2HCl+I2 | D. | FeCl2+I2═FeI2+Cl2 |