题目内容
14.含杂质80%的石灰石25g,投入500mL稀盐酸中恰好完全反应.(杂质不溶于盐酸).计算:(1)在标准状况下,生成CO2多少升?
(2)该盐酸的物质的量浓度.
分析 发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,碳酸钙物质的量为$\frac{25g×80%}{100g/mol}$=0.2mol,根据方程式计算HCl物质的量、生成二氧化碳物质的量,根据V=nVm计算二氧化碳体积,根据c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:碳酸钙物质的量为$\frac{25g×80%}{100g/mol}$=0.2mol,则:
CaCO3+2 HCl=CaCl2+CO2↑+H2O
1 2 1
0.2mol 0.4mol 0.2mol
(1)标况下,二氧化碳的体积为0.2mol×22.4L/mol=4.48L,
答:二氧化碳的体积为4.48L;
(2)该盐酸的物质的量浓度为$\frac{0.4mol}{0.5L}$=0.8mol/L,
答:该盐酸的物质的量浓度为0.8mol/L.
点评 本题考查化学方程式计算,比较基础,明确发生的反应即可解答,注意对基础知识的理解掌握.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
9.常温下,0.1mol•L-1 ROH溶液的pH=12.下列有关说法正确的是( )
| A. | c(OH-)=c(R+)=0.01mol•L-1 | B. | c(R+)>c(H+) | ||
| C. | c(ROH)<c(R+) | D. | c(ROH)<c(OH-) |
19.下列反应的离子方程式,正确的是( )
| A. | Fe2O3溶于过量的氢酸碘中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+CO32- | |
| C. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
12.下列物属于酸性氧化物的是( )
| A. | CO2 | B. | CaO | C. | H2O | D. | Na2O |

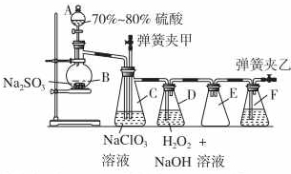 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠. (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z.