题目内容
室温下0.1mol/L的NH4CN溶液的pH等于9.32,据此,在室温下,下列说法错误的是( )
| A、上述溶液能使甲基橙试剂变黄色 |
| B、室温下,NH3?H2O是比HCN更弱的电解质 |
| C、上述溶液中CN-的水解程度大于NH4+的水解程度 |
| D、室温下,0.1mol/L NaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |
考点:盐类水解的应用
专题:盐类的水解专题
分析:室温下,0.1mol/L的NH4CN溶液的pH等于9.32,溶液呈碱性,说明CN-的水解程度大于NH4+的水解程度,则相同条件下,HCN的电离程度小于NH3?H2O的电离程度,相互促进水解的离子水解程度越大,据此分析解答.
解答:
解:室温下,0.1mol/L的NH4CN溶液的pH等于9.32,溶液呈碱性,说明CN-的水解程度大于NH4+的水解程度,则相同条件下,HCN的电离程度小于NH3?H2O的电离程度,相互促进水解的离子水解程度越大,
A.室温下,上述溶液呈碱性,则溶液能使甲基橙试剂变黄色,故A正确;
B.通过以上分析知,HCN的电离程度小于NH3?H2O的电离程度,所以NH3?H2O是比HCN更强的电解质,故B错误;
C.通过以上分析知,CN-的水解程度大于NH4+的水解程度,故C正确;
D.CN-、NH4+相互促进水解,所以0.1mol/L NaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度,故D正确;
故选B.
A.室温下,上述溶液呈碱性,则溶液能使甲基橙试剂变黄色,故A正确;
B.通过以上分析知,HCN的电离程度小于NH3?H2O的电离程度,所以NH3?H2O是比HCN更强的电解质,故B错误;
C.通过以上分析知,CN-的水解程度大于NH4+的水解程度,故C正确;
D.CN-、NH4+相互促进水解,所以0.1mol/L NaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度,故D正确;
故选B.
点评:本题考查了盐类水解,根据盐溶液酸碱性确定水解程度相对大小,知道弱根离子水解程度与弱电解质电离程度的关系,易错选项是D.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列有关说法正确的是( )
A、由-CH3、 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 | ||
B、向含有 溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降 溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降 | ||
C、有机物X、Y、M的转化关系为淀粉→X→Y
| ||
D、高分子化合物 ,其链节为对苯二甲酸和乙二醇 ,其链节为对苯二甲酸和乙二醇 |
下列有机反应类型判断错误的是( )
| A、CH4+Cl2→CH3Cl+HCl 取代反应 | ||
B、CH2=CH2+HCl
| ||
C、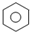 +Br2 +Br2
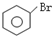 +HBr 取代反应 +HBr 取代反应 | ||
D、2CH3CH2OH+O2
|
下列说法正确的是( )
| A、分液、蒸馏、渗析、层析及色谱法、钠融法等都是混合体系分离提纯常用的方法 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、以下六种无色溶液:医用酒精、福尔马林、蚁酸溶液、甘油溶液、葡萄糖溶液、稀硫酸,用新制Cu(OH)2悬浊液及简单的实验操作即可一一鉴别 |
| D、淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 |
化学键的键能是指气态原子间形成1mol 化学键时释放的能量.如H(g)+Cl(g)═H-Cl(g)△H=-431kJ?mol-1,即H-Cl键的键能为431kJ?mol-1,也可以理解为破坏1mol H-Cl键需要吸收431kJ的能量.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,蒸发1mol H2O(l)需要吸收的能量为44kJ,其他相关数据如下表:则表中a为( )
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 |
| B、224.0 |
| C、518.8 |
| D、494.8 |
为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量.发生的化学反应为:4CuI+Hg=Cu2HgI4+2Cu.下列说法不正确的是( )
| A、上述反应属于置换反应 |
| B、该反应中的氧化剂与还原剂的物质的量之比为2:l |
| C、Cu2HgI4既是氧化产物又是还原产物 |
| D、当有1 mol CuI参与反应时,转移电子的物质的量为0.5 mol |
鼠尾草酚可用于防治骨质疏松,鼠尾草酸可两步转化得到鼠尾草酚,下列说法正确的是( )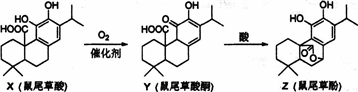

| A、X、Y、Z互为同系物 |
| B、X、Y、Z均能与FeCl3溶液发生显色反应 |
| C、1molZ与NaOH溶液反应最多消耗3molNaOH |
| D、1molY与浓溴水反应最多消耗3molBr2 |
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac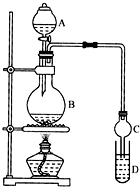 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下: