题目内容
3.在恒容密闭容器中,反应2A(g)?B(g)+C(g)△H<0达到化学平衡,下列说法正确的是( )| A. | 升高温度,平衡常数增大 | |
| B. | 增大A的浓度,A的转化率不变 | |
| C. | 增大压强,化学平衡向正反应方向移动 | |
| D. | 增大B的浓度,A的转化率增大 |
分析 A、反应是放热反应,升温平衡逆向进行;
B、增大A的浓度,相当于指定体系压强,反应前后气体体积不变,压强增大,平衡不变;
C、反应前后气体体积不变,压强改变不影响化学平衡状态;
D、B为生成物,增大B的浓度,平衡逆向进行.
解答 解:A、反应是放热反应,升温平衡逆向进行,平衡常数减小,故A错误;
B、增大A的浓度,相当于指定体系压强,反应前后气体体积不变,压强增大,平衡不变,A的转化率不变,故B正确;
C、反应前后气体体积不变,压强改变不影响化学平衡状态,化学平衡不发生移动,故C错误;
D、B为生成物,增大B的浓度,平衡逆向进行,A的转化率减小,故D错误;
故选B.
点评 本题考查了化学平衡影响因素分析,主要是反应特征和平衡移动原理的理解应用时解题关键,题目较简单.

练习册系列答案
相关题目
13.NA为阿伏加德罗常数的值,下列物质所含粒子数为0.2NA的是( )
| A. | 标准状况下,2.24 LCl2中含有的共价键数 | |
| B. | 100g质量分数为16.2%HBr溶液中的氢原子数 | |
| C. | 3.9g Na202晶体中所含的离子总数 | |
| D. | 0.1mol H2S和0.1 mol SO2混合后,体系中的硫原子数 |
14.精炼铜的过程中,电解质溶液中的[Fe2+]、[Zn2+]会逐渐增大而影响进一步电解. 甲同学设计下图除杂方案:
已知:
请回答下列问题:
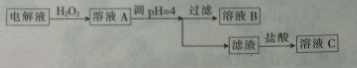
(1)加入H2O2目的是将Fe2+氧化为Fe3+.
(2)乙同学认为应将方案中的pH调节至8,你认为此观点不正确(填“正确”或“不正确”)理由是同时会使Cu2+生成沉淀而除去.
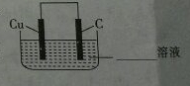
(3)利用铜棒、石墨棒和溶液C(填“B”或“C”)可设计一个原电池.该原电池的正极反应式为Fe3++e-=Fe2+.请在下图中完成该原电池的设计(标出电解质溶液和电子流动方向).
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |

(1)加入H2O2目的是将Fe2+氧化为Fe3+.
(2)乙同学认为应将方案中的pH调节至8,你认为此观点不正确(填“正确”或“不正确”)理由是同时会使Cu2+生成沉淀而除去.
(3)利用铜棒、石墨棒和溶液C(填“B”或“C”)可设计一个原电池.该原电池的正极反应式为Fe3++e-=Fe2+.请在下图中完成该原电池的设计(标出电解质溶液和电子流动方向).

11.取两份等质量的铝份和铁粉,分别与足量的盐酸反应,在相同状态下产生的气体体积之比是( )
| A. | 1:1 | B. | 3:2 | C. | 28:9 | D. | 2:3 |
18.钠和水反应
| 实验现象 | 结论或解释 |
| 1.钠浮在水面上 | 钠的密度比水小 |
| 2.钠熔成小球 | 钠的熔点低,反应剧烈 |
8.将12.8g Cu投入100mL 2mol•L-1 H2SO4和1mol•L-1 HNO3的混合溶液中,生成的气体与适量氧气完全溶于水后,恰好得到500mL溶液,该溶液为( )
| A. | 0.2 mol•L-1 的H2SO4溶液 | |
| B. | 0.2 mol•L-1 的HNO3溶液 | |
| C. | 0.2 mol•L-1 的H2SO4和HNO3混合溶液 | |
| D. | 1 mol•L-1 的H2SO4和HNO3混合溶液 |
15.下列说法中错误的是( )
| A. | 电解质溶液导电的原因是靠自由移动的阴、阳离子 | |
| B. | 电解质在水溶液中不一定完全电离 | |
| C. | 纯净的电解质在液态时,有的导电,有的不导电 | |
| D. | 无水CuSO4不导电,但胆矾中含结晶水,所以胆矾可以导电 |
7.FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.
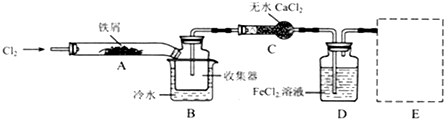
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤.
(3)如果没有装置C的设计,会导致D装置中水挥发到接受器,使FeCl3潮解.
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用: 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.
(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式:2Fe3++2H2S=2Fe2++2H++S↓.
Ⅱ.反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③既有Fe3+又有Fe2+.
为探究溶液的组成,实验如下:
综合上述实验分析,所得溶液中含有的金属阳离子有Fe3+、Fe2+.
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤.
(3)如果没有装置C的设计,会导致D装置中水挥发到接受器,使FeCl3潮解.
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用:
 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式:2Fe3++2H2S=2Fe2++2H++S↓.
Ⅱ.反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③既有Fe3+又有Fe2+.
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液. | 溶液中出现红色. | 说明:假设②不成立,假设①或③成立; 反应的离子方程式是Fe3++3SCN-=Fe(SCN)3. |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液. | 溶液紫红色退去 | 说明:假设②或③成立. |
8.下列说法中,不正确的是( )
| A. | 可利用过滤的方法分离胶体和溶液 | |
| B. | 胶体中分散质粒子直径大小在1~100nm之间 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体在一定条件下能稳定存在 |