题目内容
25℃时,0.1mol/L 的CH3COOH溶液pH=3,0.1mol/L 的HCN溶液pH=4.下列说法正确的是( )
| A、CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH |
| B、25℃时,水电离出来的c(H+)均为 10-11mol/L的两种酸,酸的浓度:HCN>CH3COOH |
| C、25℃时,浓度均为0.1 mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN |
| D、25℃时,pH均为3的CH3COOH与HCN溶液各100ml与等浓度的NaOH溶液反应,消耗NaOH溶液体积:CH3COOH>HCN |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:25℃时,0.1mol/L 的CH3COOH溶液pH=3,0.1mol/L 的HCN溶液pH=4,说明醋酸和HCN都是弱酸,不能完全电离,且醋酸的酸性比HCN强,弱酸的酸性越弱,其酸根的水解程度越强,相同物质的量的醋酸和HCN中和NaOH的能力相同,据此分析.
解答:
解:A、25℃时,0.1mol/L 的CH3COOH溶液pH=3,0.1mol/L 的HCN溶液pH=4,说明醋酸和HCN都是弱酸,不能完全电离,且醋酸的酸性比HCN强,故A错误;
B、醋酸和HCN溶液中氢离子浓度相同时,对水的电离的抑制作用相同,醋酸酸性比较HCN强,当其氢离子浓度相同时,酸的浓度:HCN>CH3COOH,故B正确;
C、醋酸的酸性比HCN强,弱酸的酸性越弱,其酸根的水解程度越强,25℃时,浓度均为0.1 mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa<NaCN,故C错误;
D、醋酸的酸性比HCN强,pH均为3的CH3COOH与HCN溶液各100ml,HCN的物质的量比醋酸大,所以消耗NaOH溶液体积:CH3COOH<HCN,故D错误;
故选B.
B、醋酸和HCN溶液中氢离子浓度相同时,对水的电离的抑制作用相同,醋酸酸性比较HCN强,当其氢离子浓度相同时,酸的浓度:HCN>CH3COOH,故B正确;
C、醋酸的酸性比HCN强,弱酸的酸性越弱,其酸根的水解程度越强,25℃时,浓度均为0.1 mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa<NaCN,故C错误;
D、醋酸的酸性比HCN强,pH均为3的CH3COOH与HCN溶液各100ml,HCN的物质的量比醋酸大,所以消耗NaOH溶液体积:CH3COOH<HCN,故D错误;
故选B.
点评:本题考查了弱酸存在电离平衡,注意弱酸的酸性越弱其电离程度越小,其酸根的水解程度越大,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
A、 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 |
| B、金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 |
| C、探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 |
| D、可用热氢氧化钠溶液鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) |
下列说法错误的是( )
| A、氧化钙用作儿童食品的干燥剂存在安全隐患 |
| B、聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
| C、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
| D、绿色化学的核心是利用化学原理对环境污染进行治理 |
用铂作电极电解1000mL 0.1mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4g.下列有关叙述正确的是(NA代表阿伏加德罗常数的值)( )
| A、电解过程中流经外电路的电子数目为0.1NA |
| B、在标准状况下,两极共产生3.92L气体 |
| C、电解后溶液的pH为2(假设溶液体积不变) |
| D、加入13.8g Ag2CO3可将溶液彻底复原 |
如图为不同温度下水的电离平衡曲线,巳知pOH=-lgc(OH -),下列说法正确的是( )


| A、T1和T2的关系是:T1>T2 |
| B、Kw的关系是:B>C>A=D=E |
| C、A点到D点:加入少量酸可实现 |
| D、T2时:pH=2的硫酸与pH=12的NaOH溶液等体枳混合,溶液呈中性 |
T°C时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X,Y,Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图2所示.下列分析正确的( )
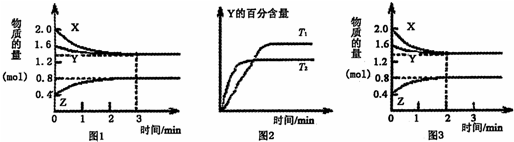

| A、容器中发生的反应可表示为:3X(g)+Y(g)?4Z(g) |
| B、0-3 min内,v(X)=0.2 mol?L-1?min-1 |
| C、若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
| D、其他条件不变升高温度,v正、v重都增大,且重新达到平衡前v正>v重 |
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)?2NH3(g)△H<0,相关数据如下表所示:下列说法正确的是 ( )
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
工业上制备重要化工原料CH3OH的反应之一为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.为了探究其反应原理,现进行如下实验,在2L恒容密闭容器内250℃条件下,测得n(CO2)随时间变化情况如表:
下列叙述正确的是( )
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
| A、v(H2)=3v(CO2)、v逆(CO2)=v正(CH3OH) |
| B、升高温度或减小压强均可使平衡常数增大 |
| C、0~3s内用H2表示的平均反应速率是0.05mol?L-1?s-1 |
| D、增大CO2浓度或选择适当的催化剂均能使该反应的反应速率增大,且平衡向正反应方向移动 |
含铀矿物通常用铅(Pb)的同位素测年法进行断代,下列关于
Pb和
Pb说法正确的是( )
206 82 |
207 82 |
| A、含不同的质子数 |
| B、含不同的电子数 |
| C、含相同的中子数 |
| D、互相转化时不属于化学变化 |