题目内容
在恒压条件下化学反应:2SO2(g)+O2(g)? ?2SO3(g);ΔH=-Q kJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列。判断下列叙述正确的是
?2SO3(g);ΔH=-Q kJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列。判断下列叙述正确的是
容器 | SO2(mol) | O2(mol) | SO3(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | 0 | Q2 |
丙 | 0 | 0 | 2 | 0 | Q3 |
丁 | 1 | 0.5 | 0 | 1 | Q4 |
A.平衡时,向甲容器中再加1mol O2,一段时间后达到平衡时O2的体积分数减小
B.平衡时,升高丙容器温度,正反应速率增大,逆反应速率减小,平衡逆向移动
C.各容器中反应放出热量的关系为:Q1=2Q2>2Q4
D.丁容器中反应达到平衡时,其化学平衡常数小于乙容器中反应的平衡常数
C
【解析】
试题分析:A、甲容器再加入1molO2,平衡虽然向正反应方向移动,但O2的体积分数增加,错误;B、升高温度,正逆反应速率都加快,错误;C、等温等压下,根据等效平衡的原理,投入量的比值相等,这两个平衡是等效平衡,Q1=2Q2,丁如果不充入N2,乙、丁是等效平衡Q2=Q4′,丁中充入1molN2压强不变,但体积增加组分的浓度降低,平衡向逆反应方向移动,Q4′>Q4,因此Q1=2Q2>2Q4正确;D、平衡常数只受温度的影响,所以乙、丁平衡常数相等,错误。
考点:考查影响平衡的移动的因素、等效平衡、化学平衡常数等相关知识。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
 H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小
H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小 2Z影响的示意图。下列叙述正确的是
2Z影响的示意图。下列叙述正确的是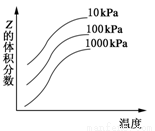
 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
 H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。