题目内容
2.实验室可利用甲醇、空气和铜制备甲醛.甲醇和甲醛的沸点和水溶性见如表:| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 混溶 |
| 甲醛 | -21 | 混溶 |

如图是两个学生设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如(甲)和(乙)所示,试回答:
(1)若按(乙)装置进行实验,则B管中应装CuO,反应的化学方程式为CH3OH+CuO$\stackrel{△}{→}$HCHO+H2O+Cu.
(2)若按(甲)装置进行实验,则通入A管的X是空气(或氧气),B中反应的化学方程式为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.
(3)C中应装的试剂是H2O.
(4)在仪器组装完成后,加试剂前都必须要进行的操作是检查装置的气密性;添加药品后,如何检验(乙)装置的气密性?导管口伸入水中,手握试管A,试管C水中有气泡生成,松手后,导气管口内形成液柱,表明装置气密性良好.
(5)两种装置中都需加热的仪器是A、B(填“A”,“B”或“C”),加热的方式分别为A水浴加热,B酒精灯加热.实验完成时,都应先停止对B(填“A”,“B”或“C”)的加热,再撤出C中导管.实验完成时,先打开D处气球的铁夹,再撤去酒精灯,打开铁夹的目的是防止倒吸,其工作原理为:气球内空气进入反应装置,装置内气体压强增大.
(6)你认为哪套装置好?并请说明理由甲,制得的甲醛溶液浓度大.
分析 本实验为物质的制备实验,因有气体参与,所以组装好装置后,应先检验装置的气密性.若按甲装置进行实验,则通入A的X是空气(或氧气),空气中的氧气做氧化剂,B中发生反应的化学方程式为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.若按乙装置进行实验,因没有通空气(或氧气)做氧化剂,则B管中应装入的物质是CuO做氧化剂用,B中发生反应的化学方程式为CH3OH+CuO$\stackrel{△}{→}$HCHO+H2O+Cu.因甲醇氧化需要加热,因此B处需加热;为了向B处不断的提供甲醇气体,A处应加热.要想检验实验后C中所得液体确为甲醛溶液,利用醛类的性质即可检验.
(1)乙装置中不通入氧气,则需要利用氧化铜氧化甲醇;
(2)甲装置中不断通入氧气,甲醇与氧气在铜的催化作用下生成甲醛;
(3)甲醛与甲醇都是有毒物质,应进行尾气处理,二者都溶于水,可以用水吸收;
(4)本实验有气体参与,所以组装好装置后,应先检验装置的气密性,根据检查装置装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(5)甲醇易挥发,利用水浴加热促进其挥发;甲醇氧化反应需要酒精灯加热;实验完成时,装置中还有一部分甲醛未完全进入C装置,用空气可以将生成的甲醛完全进入C装置,所以应先停止对B的加热,再撤出C中导管,实验完成时,先打开D处气球的铁夹,再撤去酒精灯,目的是防止倒吸;
(6)甲装置氧气充足,制得的甲醛溶液浓度大.
解答 解:(1)乙装置中利用氧化铜氧化甲醇生成甲醛,方程式:CH3OH+CuO$\stackrel{△}{→}$HCHO+H2O+Cu,
故答案为:CuO;CH3OH+CuO$\stackrel{△}{→}$HCHO+H2O+Cu;
(2)甲醇催化氧化,生成甲醛和水,反应为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O,
故答案为:空气(或氧气);2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O;
(3)甲醛与甲醇都是有毒物质,应进行尾气处理,二者都溶于水,可以用水吸收;
故答案为:H2O;
(4)本实验为利用甲醇、空气和铜制备甲醛的实验,有气体参与,所以组装好装置后,应先检验装置的气密性,添加药品后,检验(乙)装置的气密性的方法为:导管口伸入水中构成封闭体系,手握试管A加热,封闭气体热胀冷缩,试管C水中有气泡生成,松手后,导气管口内形成液柱,表明装置气密性良好,
故答案为:检查装置的气密性;导管口伸入水中,手握试管A,试管C水中有气泡生成,松手后,导气管口内形成液柱,表明装置气密性良好;
(5)甲醇的沸点只有65℃,所以利用水浴加热促进其挥发,所以A处用水浴加热;甲醇氧化反应需要温度较高,所以B处用酒精灯加热;实验结束时,装置中还有一部分甲醛未完全进入C装置,用空气可以将生成的甲醛完全进入C装置,所以应先停止对B的加热,再撤出C中导管,因气球内空气进入反应装置,装置内气体压强增大,能防止倒吸,所以实验完成时,先打开D处气球的铁夹,再撤去酒精灯,
故答案为:A、B; A水浴加热,B酒精灯加热; B; 撤出C中导管; 防止倒吸 气球内空气进入反应装置,装置内气体压强增大;
(6)若按甲装置进行实验,则通入A的X是空气(或氧气),空气中的氧气做氧化剂,B中发生反应的化学方程式为2CH3OH+O2$→_{△}^{Cu}$2HCHO+2H2O.若按乙装置进行实验,因没有通空气(或氧气)做氧化剂,则B管中应装入的物质是CuO做氧化剂用,B中发生反应的化学方程式为CH3OH+CuO$\stackrel{△}{→}$HCHO+H2O+Cu,显然,甲装置氧气充足,制得的甲醛溶液浓度大,甲装置好,
故答案为:甲,制得的甲醛溶液浓度大.
点评 本题为实验题考查了甲醛的制备,熟悉醇的催化氧化反应是解题关键,注意反应物与生成物的性质,题目难度中等.

| A. | c1:c2>1:2 | |
| B. | A和B的转化率不相等 | |
| C. | 平衡时,B和C的生成速率之比1:1 | |
| D. | c2的取值范围为0<c2<0.28 mol•L-1 |
I、在2L密闭容器内,800℃时反应:2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图1中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.

(3)能说明该反应已达到平衡状态的是BE.
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.NO、O2、NO2的浓度之比为2:1:2 D.容器内密度保持不变
E.容器内气体的颜色不再变化
(4)缩小容器体积使压强增大,平衡向正反应方向移动(填“正”或“逆”),K值不变(填“增大”、“减小”或“不变”)
II、一定温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)△H>0,起始时,c(A)=0.2mol/L,c(B)=0.6mol/L,c(C)=0.4mol/L.当平衡时,下列数据可能存在的是bc.
a.c(A)=0.4mol/L b.c(B)=1.0mol/L
c.c(A)=0.3mol/L且c(C)=0.2mol/L d.c(C)=1.0mol/L
III、常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图2所示,则图中表示醋酸溶液中pH变化曲线的是b(填“a”或“b”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1<m2(选填“<”、“=”、“>”).
| A. | K+、CO32-、Cl-、NO3- | B. | MnO4-、K+、OH-、SO42- | ||
| C. | Cl-、SO42-、Cu2+、Ba2+ | D. | Mg2+、Na+、NO3-、Cl- |
| A. | 苯和酒精 | B. | 四氯化碳和溴 | C. | 苯和水 | D. | 醋酸和水 |


 +2H2O.
+2H2O.
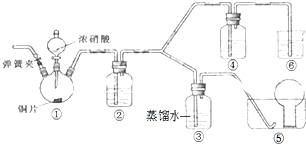 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.