题目内容
2.反应2SO2+O2?2SO3,经过一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.02mol•L-1•s-1,则这段时间为( )| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
分析 根据速率之比等于化学计量数之比计算v(O2),再利用△t=$\frac{△c}{v}$计算所用的时间.
解答 解:一段时间后SO3的浓度增加了0.4mol•L-1,那么氧气的浓度必然减少0.2mol•L-1,根据v(O2)=$\frac{△c}{△t}$=$\frac{0.2mol/L}{t}$=0.02mol•L-1•s-1 故t=10s.故选D.
点评 本题考查化学反应速率的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
12.可逆反应2NO 2?2NO+O 2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
| A. | 单位时间内生成n mo1 O2的同时生成2n mol NO2 | |
| B. | 单位时间内生成n mol O2的同时生成2n mol NO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的密度不再改变的状态 |
13.下列有机反应类型判断不正确的是( )
| A. | ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应 | |
| B. |  +CH${\;}_{{\;}_{3}}$CH2OH→ +CH${\;}_{{\;}_{3}}$CH2OH→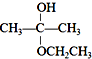 加成反应 加成反应 | |
| C. | HOCH2CH2CH2OH$\stackrel{浓硫酸}{→}$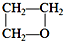 +H2O消去反应 +H2O消去反应 | |
| D. | nCH2=O$\stackrel{一定条件}{→}$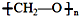 加聚反应 加聚反应 |
10.下表中,对有关除杂的方法不正确的是( )
| 物质 | 杂质 | 方法 | |
| A | 乙烷 | 乙烯 | 一定条件下与H2反应使乙烯转化为乙烷 |
| B | 乙炔 | H2S | 通入CuSO4溶液的洗气瓶洗气 |
| C | 溴苯 | Br2 | 加NaOH溶液后分液 |
| D | 工业酒精 | H2O(转为无水酒精) | 加入生石灰,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
17.以下化合物中,既含有离子键,又含有极性键的是( )
| A. | NaOH | B. | Na2O2 | C. | MgCl2 | D. | H2O2 |
7.现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C,在周期表中的位置是第二周期 IVA族.
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式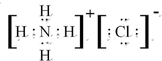 .
.
(3)写出元素X、T形成的化合物XT2的电子式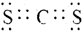 .
.
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b、d、e(填序号)
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: ,
,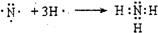 .
.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数比内层电子总数少4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 与氢形成的气态化合物在标准状况下的密度为0.76g•L-1 |
| Z | 元素最高正价与负价的绝对值之差是6 |
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式
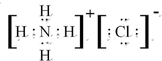 .
.(3)写出元素X、T形成的化合物XT2的电子式
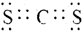 .
.(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b、d、e(填序号)
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程:
 ,
,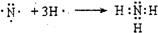 .
.
5.某学习研究小根据金属锌、铝、铁分别与稀盐酸反应的相对速率,探究金属锌、铝、铁的金属活动性和反应速率测定.
【实验设计】为了达到实验目的,必须控制实验条件.你认为控制的实验条件是(可填满也可不填满)
(1)反应体系的温度(相同);(2)盐酸的浓度(相同);(3)取用盐酸的体积(相同);(4)金属的(比)表面积(或金属粉末的粗细程度)(相同).
【实验探究】该学习研究小组在上述实验条件相同的情况下,进行三组实验:各量取50mL稀盐酸于小烧杯中,分别同时加入足量的三种表面无氧化膜的金属片,用pH计测定溶液的pH并将信息传输到电脑,电脑动态地绘制出溶液中c(H+)随时间t的变化曲线(反应过程中溶液的体积没有变化).图1是反应到t1s时电脑记录的曲线:
【交流与表达】根据上述c(H+)随时间t的变化曲线回答下列问题: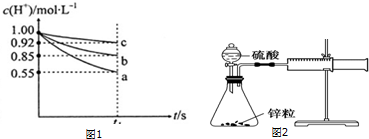
(1)表示金属活动性最弱的金属与H+反应的变化曲线是c(填“a”、“b”或“c”编号).
(2)在同一时间内,表示不同反应的反应速率可以有:同温同压下放出氢气的体积V(H2);溶液中H+浓度的减少△c(H+);固体减少的量△m或△n.在0一t1s之间,设A1和Zn分别与盐酸反应的速率为v(Al)和v(Zn):
Ⅰ.若以溶液中c(H+)减少来表示不同反应的速率,即v(Al):v(Zn)═3:1;
Ⅱ.若以固体质量的减轻来表示不同反应的速率,即v(Al):v(Zn)═54:65;
Ⅲ.若以固体物质的量减少来表示不同反应的速率,即v(Al):v(Zn)═2:1.
IV.可以利用图2所示的装置测定不同浓度的硫酸与锌的反应速率,请回答下列问题:
按照上述装置图安装3套相同的装置,并检验装置气密性良好,将注射器的活栓推至“0”刻度处;然后在三个锥形瓶中分别放入相同形状的锌粒2g,并分别通过分液漏斗在锥形瓶中加入1mol•L-1、2mol•L-1和4mol•L-1的稀硫酸40mL.请补全下表空白:
请选择一组合适的数据填写在第②组实验中的a、b处B.
A.12和0.83B.6和1.67C.1和10D.6和3.67.
【实验设计】为了达到实验目的,必须控制实验条件.你认为控制的实验条件是(可填满也可不填满)
(1)反应体系的温度(相同);(2)盐酸的浓度(相同);(3)取用盐酸的体积(相同);(4)金属的(比)表面积(或金属粉末的粗细程度)(相同).
【实验探究】该学习研究小组在上述实验条件相同的情况下,进行三组实验:各量取50mL稀盐酸于小烧杯中,分别同时加入足量的三种表面无氧化膜的金属片,用pH计测定溶液的pH并将信息传输到电脑,电脑动态地绘制出溶液中c(H+)随时间t的变化曲线(反应过程中溶液的体积没有变化).图1是反应到t1s时电脑记录的曲线:
【交流与表达】根据上述c(H+)随时间t的变化曲线回答下列问题:

(1)表示金属活动性最弱的金属与H+反应的变化曲线是c(填“a”、“b”或“c”编号).
(2)在同一时间内,表示不同反应的反应速率可以有:同温同压下放出氢气的体积V(H2);溶液中H+浓度的减少△c(H+);固体减少的量△m或△n.在0一t1s之间,设A1和Zn分别与盐酸反应的速率为v(Al)和v(Zn):
Ⅰ.若以溶液中c(H+)减少来表示不同反应的速率,即v(Al):v(Zn)═3:1;
Ⅱ.若以固体质量的减轻来表示不同反应的速率,即v(Al):v(Zn)═54:65;
Ⅲ.若以固体物质的量减少来表示不同反应的速率,即v(Al):v(Zn)═2:1.
IV.可以利用图2所示的装置测定不同浓度的硫酸与锌的反应速率,请回答下列问题:
按照上述装置图安装3套相同的装置,并检验装置气密性良好,将注射器的活栓推至“0”刻度处;然后在三个锥形瓶中分别放入相同形状的锌粒2g,并分别通过分液漏斗在锥形瓶中加入1mol•L-1、2mol•L-1和4mol•L-1的稀硫酸40mL.请补全下表空白:
| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率mL•min-1 |
| ① | 1mol•L-1 | 11 | 10 | |
| ② | 2mol•L-1 | a | 10 | b |
| ③ | 4mol•L-1 | 10 | 5.0 |
A.12和0.83B.6和1.67C.1和10D.6和3.67.
 .
.