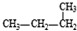题目内容
4.工业上接触法制硫酸过程中,在沸腾炉中煅烧硫铁矿(主要成分为FeS2)的化学方程式为:4FeS2+11O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+8SO2请回答下列问题:
(1)已知S为-1价,则被氧化的元素是硫和铁.
(2)若煅烧1.0t的硫铁矿(杂质含量为30%,杂质中不含硫元素),且FeS2的转化率为90%,则标准状况下,生成的SO2体积为235.2m3.
(3)若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之.简述实验操作和有关的实验现象取少量炉渣,用稀硫酸溶解并过滤,在滤液中滴加几滴KMnO4溶液,溶液褪色可证明炉渣中含有+2价的铁元素
供选择的试剂:CuSO4溶液、稀硫酸、KMnO4溶液、品红溶液、NaOH溶液等
(4)炉渣经提纯可制得FeCl3,电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路版.请写出FeCl3溶液与铜反应的化学方程式2FeCl3 +Cu=2FeCl2 +CuCl2.检验反应后的溶液中存在Fe3+的试剂可用KSCN溶液欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,下列试剂中,需要用到的一组是(填字母)A.
①蒸馏水 ②铁粉 ③浓硝酸 ④稀盐酸 ⑤浓氨水 ⑥氯水
A.①②④⑥B.①③④⑥C.②④⑤D.①④⑥
分析 (1)S为-1价,则铁为+2价,该反应中硫元素和铁元素的化合价都升高,在反应中被氧化;
(2)根据反应方程式结合题中数据计算出生成的二氧化硫的体积;
(3)检验亚铁离子,通常使用酸性高锰酸钾溶液,需要用稀硫酸溶解样品,据此设计实验方案;
(4)铜与氯化铁反应生成氯化铁、氯化亚铁;
检验溶液中Fe3+存在通常用KSCN溶液,溶液变红说明Fe3+存在;
根据先用过量铁粉将铜离子转化成铜单质,然后加入盐酸消耗掉过量的铁粉,再加入氯水将亚铁离子还原成铁离子,据此选择使用的试剂.
解答 解:(1)反应4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3 +8SO2中,FeS2的S元素为-1价,则铁元素为+2价,反应后生成+3价的氧化铁和+4价的S,则铁元素和硫元素在反应中都被氧化,
故答案为:铁和硫;
(2)若煅烧1.0t的硫铁矿(杂质含量为30%,杂质中不含硫元素),且FeS2的转化率为90%,则
4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3 +8SO2,
480g 8×22.4L
1×106g×(1-30%)×90% V(SO2)
列出比例:$\frac{480g}{1×1{0}^{6}g×(1-30%)×90%}$=$\frac{8×22.4L}{V(S{O}_{2})}$
则:V(SO2)=235200L=235.2m3,
故答案为:235.2;
(3)若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,利用稀酸溶解后生成的亚铁离子具有还原性,而KMnO4溶液具有强氧化性,可使KMnO4溶液褪色,则选择试剂为稀硫酸、KMnO4溶液,操作方法及现象为:取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,则证明炉渣中混有+2价的铁元素,
故答案为:取少量炉渣,用稀硫酸溶解并过滤,在滤液中滴加几滴KMnO4溶液,溶液褪色可证明炉渣中含有+2价的铁元素;
(4)铜与氯化铁反应生成氯化铁、氯化亚铁,反应方程式为:2FeCl3+Cu═2FeCl2+CuCl2,
检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液与试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,腐蚀废液中含氯化铜、氯化亚铁以及氯化铁,加入过量的铁和氯化铁反应生成氯化亚铁,和氯化铜反应生成金属铜和氯化亚铁,即Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+,过滤,所得的滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,Fe+2H+=Fe2++H2↑,向滤渣中加入足量的盐酸可以将铜分离,再过滤,得到的滤液是氯化亚铁,氯气具有氧化性,能将亚铁离子氧化为三价铁,2Fe2++Cl2=2Fe3++2Cl-,最后向滤液中通入氯气即可,则选用的试剂有:①蒸馏水、②铁粉、④稀盐酸、⑥氯水,
故答案为:2FeCl3+Cu═2FeCl2+CuCl2;KSCN溶液;A.
点评 本题考查性质实验方案的设计,题目难度中等,涉及化学方程式书写、化学方程式计算、性质方案设计、氧化还原反应判断、常见离子检验方法知识,明确常见物质性质为解答关键,试题培养了学生的分析能力及化学计算、化学实验能力.

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案| A. | 正极为Cu,负极为Fe,电解质为FeCl3溶液 | |
| B. | 负极为Fe,正极为C,电解质为Fe(NO3)2溶液 | |
| C. | 正极为Ag,负极为Fe,电解质为Fe2(SO4)3溶液 | |
| D. | 负极为Fe,正极为Pt,电解质为Fe2(SO4 )3溶液 |
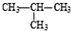
| A. | 1molC20H42中含有的共价键数目为60nA | |
| B. | 1molCl2通过足量的NaOH溶液中充分反应转移的电子数为nA | |
| C. | a g 某气体含分子数为b,c g 该气体在标况下的体积为22.4bc/(a nA)升 | |
| D. | 2.24L(标况)辛烷在32 g 氧气中充分燃烧,生成CO2的分子数为0.8nA |
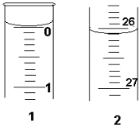 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化.直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为0.00mL,终点读数为26.10mL;所用盐酸溶液的体积为26.10mL.
(4)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
 和
和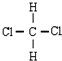
 和
和