题目内容
 用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(盛有KNO3琼脂的U型管)构成一个原电池.以下有关该原电池的叙述正确的是
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(盛有KNO3琼脂的U型管)构成一个原电池.以下有关该原电池的叙述正确的是①在外电路上,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③盐桥中的NO3-移向AgNO3溶液,K+移向Cu(NO3)2溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同( )
| A、①② | B、②③ | C、②④ | D、③④ |
考点:原电池和电解池的工作原理
专题:
分析:该原电池为银铜原电池,铜比银活泼,故铜为负极,银为正极,负极反应式为:Cu-2e-=Cu2+,正极:Ag++e-=Ag,根据原电池的工作原理得出正确结论.
解答:
解:①在外电路中,电子由负极流向正极,故电由正极流向负极,故电流由银电极流向铜电极,故①错误;
②银为正极,电极反应式为:Ag++e-=Ag,故②正确;
③根据阳离子移向正极,阴离子移向负极,则盐桥中的NO3-移向负极Cu(NO3)2溶液,K+移向AgNO3溶液,故③错误;
④该原电池的电极反应式为:负极:Cu-2e-=Cu2+正极:Ag++e-=Ag,故总反应为Cu+2Ag+=Cu2++2Ag.铜片与硝酸银反应的离子方程式为Cu+2Ag+=Cu2++2Ag,与原电池的总反应相同,故④正确.
故选C
②银为正极,电极反应式为:Ag++e-=Ag,故②正确;
③根据阳离子移向正极,阴离子移向负极,则盐桥中的NO3-移向负极Cu(NO3)2溶液,K+移向AgNO3溶液,故③错误;
④该原电池的电极反应式为:负极:Cu-2e-=Cu2+正极:Ag++e-=Ag,故总反应为Cu+2Ag+=Cu2++2Ag.铜片与硝酸银反应的离子方程式为Cu+2Ag+=Cu2++2Ag,与原电池的总反应相同,故④正确.
故选C
点评:本题考察了原电池和电解池的工作原理及电极反应式和总反应方程式的书写,明确电极、电极反应即可解答,题目难度不大.

练习册系列答案
相关题目
下列有关钠的叙述正确的是( )
| A、钠在空气中燃烧发出黄色的火焰 |
| B、钠在空气中燃烧生成淡黄色的氧化钠 |
| C、将金属钠加入硫酸铜溶液中有红色的铜生成 |
| D、将钠放入CCl4中密封保存 |
化学与生活息息相关,以下日常生活的做法或判断合理的是( )
| A、新铝锅使用后颜色变暗用砂纸打磨 |
| B、某矿泉水暴露于空气中变黄是因为水中可能含有Fe2+ |
| C、氯气泄漏后应逆风向低处跑 |
| D、用米汤检验某食盐是否为加碘盐 |
PH=5的某强酸溶液用水冲稀至原浓度的
时,这时溶液的PH值是( )
| 1 |
| 1000 |
| A、8 |
| B、5×10-3 |
| C、接近于7 |
| D、等于7 |
| E、2<PH<5 |
化学概念在逻辑上存在如图所示的三种关系,下列说法错误的是( )
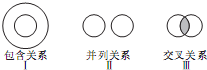

| A、烃与烷烃属于I |
| B、电解质与非电解质属于Ⅱ |
| C、离子反应与氧化还原反应属于Ⅲ |
| D、酸性氧化物与非金属氧化物属于I |
下列指定反应的离子方程式正确的是( )
| A、用白醋除铁锈:Fe2O3?xH2O+6H+=(3+x)H2O+2Fe3+ |
| B、用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH-=2NO3-+H2O |
| C、将少量SO2气体通入氨水中:SO2+NH3?H2O=NH4++HSO3- |
| D、向稀硫酸中加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
含NO3-的工业废水会造成水体富营养化,可利用如下反应将其转化为无毒、无污染的N2:A1+口+口→口十口+口,反应中涉及到的另外3种微粒是H2O、A1(OH)3、OH-.下列说法正确的是( )
| A、反应中的Al被还原,NO3-是还原剂 |
| B、三种反应物分别是Al、NO3-和OH- |
| C、若有1 mol Al参加反应,则有0.6 mol NO3-被还原 |
| D、随着反应的进行,溶液的碱性逐渐减弱 |