题目内容
19.把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3molNO2和0.2molNO,下列说法正确的是( )| A. | 反应后生成的盐只有Fe(NO3)3 | |
| B. | 反应后生成的盐只有Fe(NO3)2 | |
| C. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3:1 | |
| D. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1:3 |
分析 n(Fe)=$\frac{22.4g}{56g/mol}$=0.4mol,反应只收集到0.3molNO2和0.2molNO,转移电子物质的量=0.3mol×(5-4)+0.2mol×(5-2)=0.9mol,假设Fe完全生成Fe3+,转移电子物质的量=0.4mol×3=1.2mol>0.9mol,假设Fe完全只生成Fe2+,转移电子物质的量=0.4mol×2=0.8mol<0.9mol,所以Fe反应生成物有Fe(NO3)3和Fe(NO3)2,利用转移电子守恒计算二者物质的量之比.
解答 解:n(Fe)=$\frac{22.4g}{56g/mol}$=0.4mol,反应只收集到0.3molNO2和0.2molNO,转移电子物质的量=0.3mol×(5-4)+0.2mol×(5-2)=0.9mol,假设Fe完全生成Fe3+,转移电子物质的量=0.4mol×3=1.2mol>0.9mol,假设Fe完全只生成Fe2+,转移电子物质的量=0.4mol×2=0.8mol<0.9mol,所以Fe反应生成物有Fe(NO3)3和Fe(NO3)2,
设Fe(NO3)3和Fe(NO3)2的物质的量分别是xmol、ymol,
结合转移电子守恒得$\left\{\begin{array}{l}{x+y=0.4}\\{3x+2y=0.9}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.3}\end{array}\right.$,所以Fe(NO3)3和Fe(NO3)2的物质的量之比=0.1mol:0.3mol=1:3,
故选D.
点评 本题考查氧化还原反应的有关计算,为高频考点,正确判断含Fe化合物种类是解本题关键,注意原子守恒的灵活运用,题目难度不大.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 标准状况下,气体摩尔体积约为22.4 L/mol | |
| B. | 非标准状况下,1mol任何气体都不可能为22.4L | |
| C. | 标准状况下,22.4L任何气体的物质的量都约为1mol | |
| D. | 标准状况下,1 molH2O的体积小于22.4L |
| A. | 100mL 0.1mol/L K2SO4溶液中,含有氧原子数为0.04NA | |
| B. | 标准状况下,2.24L氯气溶于水发生反应,转移电子数目为0.1NA | |
| C. | 1mol Na与足量O2反应生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中,含有0.2NAOH- |
| A. | CH4和CH3-CH2-CH3 | B. | C2H5-OH和C6H5-OH | ||
| C. | CH3-CH2-CH2-CH3和 | D. | C2H4和C3H4 |

| A. | “K”属于芳香烃 | |
| B. | “K”的苯环上的一硝基取代产物有5种 | |
| C. | “K”中含有三种官能团 | |
| D. | 11mol“K”最多可和6molH2发生加成反应 |

| A. | 该能量转化系统中的水也是可以循环的 | |
| B. | 燃料电池放电时的负极反应:H2-2e-+2OH-═2H2O | |
| C. | 水电解系统中的阳极反应:4OH--4e-═2H2O+O2↑ | |
| D. | 燃料电池系统产生的能量实际上来自于水 |

| A. | A与B互为同系物 | |
| B. | A与B都能与溴的四氯化碳溶液发生加成反应 | |
| C. | 在一定条件下,A与B均能发生取代反应 | |
| D. | A与B都能与碳酸氢钠反应产生氢气 |



 、I
、I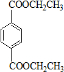 .
.
 .
.