题目内容
14.某物质的分子式为C8H14O2写出同时满足下列条件该物质的链状结构简式:
①能发生银镜反应 ②核磁共振氢谱有2个吸收峰.
分析 核磁共振氢谱有2个吸收峰,说明分子中含有2种H原子,分子中H原子数目很多,故该同分异构体为对称结构,为链状结构;分子式为C8H14O2的不饱和度为$\frac{8×2+2-14}{2}$=2,能发生银镜反应,故含有醛基2个-CHO.
解答 解:分子式为C8H14O2的不饱和度为$\frac{8×2+2-14}{2}$=2,核磁共振氢谱有2个吸收峰,说明分子中含有2种H原子,分子中H原子数目很多,故该同分异构体为对称结构,为链状结构,不饱和度为2,能发生银镜反应,故含有醛基2个-CHO,其余的H原子以甲基形式存在,另外的O原子为对称结构的连接原子,故符合条件的同分异构体的结构简式为: ;
;
故答案为: .
.
点评 本题考查了有机物的结构,掌握有机物的结构特点以及同分异构体的书写技巧为解答关键,题目难度中等.

练习册系列答案
相关题目
12.下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物
②CH3COOH、HCl、H2CO3分别为一元酸、一元酸、二元酸
③CuSO4•5H2O、水银、烧碱、H2SO4均为化合物
④C60、C70、金刚石、石墨为四种单质.
①液氯、氨水、干冰、碘化银均为纯净物
②CH3COOH、HCl、H2CO3分别为一元酸、一元酸、二元酸
③CuSO4•5H2O、水银、烧碱、H2SO4均为化合物
④C60、C70、金刚石、石墨为四种单质.
| A. | ①③④ | B. | ②③ | C. | ②④ | D. | ②③④ |
2.过氧化氢,熔点-0.41℃.沸点150.2℃.无色透明液体,溶于水、醇、乙醚.具有较强的氧化能力,为强氧化剂.当遇热、光、粗糙表面、重金属、二氧化锰及其他杂质时,则发生剧烈分解,并放出大量的热,与可燃物接触可产生氧化自燃.化学工业上常用作制造过碳酸钠、过氧乙酸等过氧化物的原料;在生活中主要用作食品加工、食品的漂白、防腐和保鲜剂.某班同学在学习完过课本有关过氧化氢性质后,分成甲、乙、丙三组分别开展了相关的探究活动.现请就他们活动中的一些内容回答下列问题.

1.甲组同学以“寻找常温下能加速过氧化氢分解的催化剂,并通过实验比较它们的效果”为课题开展研究,
(1)经过初步研究,他们选定了五种物质进行两两对比实验.下列实验组不可能为相应的猜想提供证据的是A
(2)他们在对比实验过程中的如下操作,你认为不正确的是D
A.在同组实验时,都使用量筒量取相同量的过氧化氢溶液
B.在同组实验时,都使用托盘天平称取相同量的固体样品
C.在同组实验时,控制同组实验的浓度、用量等条件一致
D.在同组实验时,其中一个实验使用酒精灯加热
(3)图1是他们设计的四组实验装置.在两两对比实验中,下列观察(或测定)方法最难以比较样品对过氧化氢分解加速效果的是C
A.第一组是同时实验,观察比较反应过程中两个气球体积的变化情况
B.第二组是同时实验,观察比较反应过程中两者产生气泡的快慢
C.第三组是分两次实验,看木条是否能复燃
D.第四组是分两次实验,比较反应过程中收集一定体积氧气所需的时间
2.乙组用市售过氧化氢溶液配成15%左右过氧化氢溶液,采用下列装置如图2(装置气密性良好)以过氧化氢代替氯酸钾制取氧气.进行实验.在有不少气泡产生数分钟后,用排空气法收集一试管气体,用带火星的木条检验.带火星的木条并不复燃.
a.加热的时间还不够长,试管内氧气的蓄积量不够多(观察与猜想).
b.产生气泡的速度太慢,应提高温度加快产生气泡的速度(观察与假设).
c.过氧化氢溶液浓度过小.
增大过氧化氢溶液的浓度,延长加热时间,在反应速率明显加快的情况下,用带火星木条检验,仍不复燃.
在经过重新讨论后,该小组同学将收集气体的方法改为排水法收集后,并用带火星木条检验,木条复燃.则原先带火星木条并不复燃的原因可能是:a.加热时产生的氧气在温度较高时形成热气流逸散到试管口外的空气中.b.过氧化氢溶液中水的含量超过过氧化氢的含量,加热时除产生氧气而外,还产生大量水蒸汽,致使试管内氧气的含量过少.
3.丙组同学将H2O2溶液滴入含有酚酞的NaOH中,发现红色消失.A同学认为这是由于H2O2是二元弱酸(H2O2?H++HO2-),消耗了OH-,而使红色褪去.B同学认为H2O2具有强氧化性,将酚酞氧化,红色消去.试设计实验论证两位同学的解释中谁正确:a.加热时产生的氧气在温度较高时形成热气流逸散到试管口外的空气中;b.过氧化氢溶液中水的含量超过过氧化氢的含量,加热时除产生氧气而外,还产生大量水蒸汽,致使试管内氧气的含量过少.

1.甲组同学以“寻找常温下能加速过氧化氢分解的催化剂,并通过实验比较它们的效果”为课题开展研究,
(1)经过初步研究,他们选定了五种物质进行两两对比实验.下列实验组不可能为相应的猜想提供证据的是A
| 组 别 | 猜 想 | 实验组 |
| A | 较活泼金属的氧化物催化效果好 | 氧化铁和铁丝 |
| B | 较活泼的金属单质催化效果好 | 铜丝和铁丝 |
| C | 高价的金属氧化物催化效果好 | 氧化亚铁和氧化铁 |
| D | 氧化物比单质催化效果好 | 氧化铜和铜丝 |
A.在同组实验时,都使用量筒量取相同量的过氧化氢溶液
B.在同组实验时,都使用托盘天平称取相同量的固体样品
C.在同组实验时,控制同组实验的浓度、用量等条件一致
D.在同组实验时,其中一个实验使用酒精灯加热
(3)图1是他们设计的四组实验装置.在两两对比实验中,下列观察(或测定)方法最难以比较样品对过氧化氢分解加速效果的是C
A.第一组是同时实验,观察比较反应过程中两个气球体积的变化情况
B.第二组是同时实验,观察比较反应过程中两者产生气泡的快慢
C.第三组是分两次实验,看木条是否能复燃
D.第四组是分两次实验,比较反应过程中收集一定体积氧气所需的时间
2.乙组用市售过氧化氢溶液配成15%左右过氧化氢溶液,采用下列装置如图2(装置气密性良好)以过氧化氢代替氯酸钾制取氧气.进行实验.在有不少气泡产生数分钟后,用排空气法收集一试管气体,用带火星的木条检验.带火星的木条并不复燃.
a.加热的时间还不够长,试管内氧气的蓄积量不够多(观察与猜想).
b.产生气泡的速度太慢,应提高温度加快产生气泡的速度(观察与假设).
c.过氧化氢溶液浓度过小.
增大过氧化氢溶液的浓度,延长加热时间,在反应速率明显加快的情况下,用带火星木条检验,仍不复燃.
在经过重新讨论后,该小组同学将收集气体的方法改为排水法收集后,并用带火星木条检验,木条复燃.则原先带火星木条并不复燃的原因可能是:a.加热时产生的氧气在温度较高时形成热气流逸散到试管口外的空气中.b.过氧化氢溶液中水的含量超过过氧化氢的含量,加热时除产生氧气而外,还产生大量水蒸汽,致使试管内氧气的含量过少.
3.丙组同学将H2O2溶液滴入含有酚酞的NaOH中,发现红色消失.A同学认为这是由于H2O2是二元弱酸(H2O2?H++HO2-),消耗了OH-,而使红色褪去.B同学认为H2O2具有强氧化性,将酚酞氧化,红色消去.试设计实验论证两位同学的解释中谁正确:a.加热时产生的氧气在温度较高时形成热气流逸散到试管口外的空气中;b.过氧化氢溶液中水的含量超过过氧化氢的含量,加热时除产生氧气而外,还产生大量水蒸汽,致使试管内氧气的含量过少.
19.把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3molNO2和0.2molNO,下列说法正确的是( )
| A. | 反应后生成的盐只有Fe(NO3)3 | |
| B. | 反应后生成的盐只有Fe(NO3)2 | |
| C. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3:1 | |
| D. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1:3 |
6.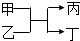 若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
 若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )| A. | 钠和氢气 | B. | 硫和氧气 | C. | 碳和硅 | D. | 氯气和溴单质 |
3.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4═3N2↑+4H2O,反应温度可高达2700℃,若有1mol N2H4被氧化,则下列判断不正确的是( )
| A. | 生成33.6LN2(标准状况下) | B. | 被还原的N原子的物质的量为2mol | ||
| C. | 转移电子的物质的量为4 mol | D. | 还原产物比氧化产物多0.5mol |
4.下列各组物质中,两者互为同分异构体的是( )
| A. | 2CaSO4•H2O和CaSO4•2H2O | B. | CH3CH2OH与CH3OCH3 | ||
| C. | CuSO4•3H2O与CuSO4•5H2O | D. | H2O与D2O(重水) |