题目内容
5. 在如图各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
在如图各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:(1)写出反应②的化学反应方程式2Na2O2+2H2O=4NaOH+O2↑,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是0.2mol.
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间,C和D的焰色反应均为黄色.则反应①的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O.
(3)若反应①是实验室制氯气,则该反应的离子方程式是MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O.
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水.则A过量时反应①的离子反应方程式是AlO2-+4H+=Al3++2H2O.
分析 (1)E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成的G为常见的无色气体,则E为H2O,F为Na2O2,G为O2;
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间,C和D的焰色反应均为黄色,则A为氯气,B为氢氧化钠,反应生成氯化钠、次氯酸钠与水;
(3)反应①是实验室制氯气,应是二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水;
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水,则A为强酸,如硫酸,B为偏铝酸盐,如偏铝酸钠.
解答 解:(1)E常温下为无色无味的液体,F为淡黄色粉末,二者反应生成的G为常见的无色气体,则E为H2O,F为Na2O2,G为O2,反应②的化学反应方程式:2Na2O2+2H2O=4NaOH+O2↑,在该反应中,每生成2.24L氧气(标准状况),其物质的量为0.1mol,该反应转移电子的物质的量是:0.1mol×2=0.2mol,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;0.2mol;
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间,C和D的焰色反应均为黄色,则A为氯气,B为氢氧化钠,反应生成氯化钠、次氯酸钠与水,反应①的化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(3)反应①是实验室制氯气,应是二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水,则A为强酸,如硫酸,B为偏铝酸盐,如偏铝酸钠,则A过量时反应①的离子反应方程式是:AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O.
点评 本题考查无机物推断,基本属于猜测验证型题目,需要学生熟练掌握元素化合物性质,难度中等.

| A. | 用氯胺处理自来水:NH2Cl+H2O?NH2OH+HCl | |
| B. | 在含有Mg2+、HCO3-的自来水中加入过量的澄清石灰水:Ca2++Mg2++2OH-+2HCO3-═CaCO3↓+MgCO3↓+2H2O | |
| C. | 长时间煮沸含Mg2+、HCO3-的自来水:Mg2++2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+2CO2↑ | |
| D. | Na2FeO4既是混凝剂、又可作消毒剂,作混凝剂的作用原理为:Fe3++3H2O═Fe(OH)3(胶体)+3H+ |
| A. | 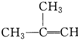 -CH3+Br2→ -CH3+Br2→ | |
| B. | CH2=CH-CH3+HCl→ | |
| C. | CH2=CH-CH=CH2+Br2→ | |
| D. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ |
| A. |  分子中至少有9个碳原子处于同一平面上 分子中至少有9个碳原子处于同一平面上 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 某烯烃与氢气加成后得到2,2-二甲基丁烷,该烯烃的名称是3,3-二甲基-1-丁烯 | |
| D. | 能够测定分子化学键的方法是核磁共振谱 |
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 从海水可获得在常温下为液体的单质是Br2 |
| A. | Fe2+不能与SCN-形成血红色化合物 | B. | 该晶体中一定含有SCN- | ||
| C. | Fe3+的氧化性比氯气的氧化性强 | D. | Fe2+被氯气氧化成Fe3+ |
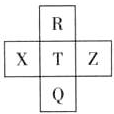 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 单质的沸点:T>Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T<Q |
| A. | 水分子的结构式是H-Cl-O | |
| B. | NaCl的电子式为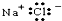 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为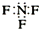 |