题目内容
5.写出下列各组盐溶液混合后发生反应的离子方程式.①FeCl3和Na2CO32Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,
②Al2(SO4)3和NaHCO3Al3++3HCO3-=Al(OH)3↓+3CO2↑.
分析 ①相互促进水解生成氢氧化铁、二氧化碳;
②相互促进水解生成氢氧化铝、二氧化碳.
解答 解:①FeCl3和Na2CO3 混合的离子反应为2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,故答案为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
②Al2(SO4)3和NaHCO3混合的离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
16.下列叙述不正确的是( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3.
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
20.下列说法正确的是( )
| A. | 乳酸薄荷醇酯(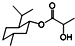 )不仅能发生氧化、消去反应,还能发生取代反应 )不仅能发生氧化、消去反应,还能发生取代反应 | |
| B. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 按系统命名法,化合物 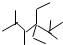 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 化合物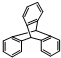 是苯的同系物 是苯的同系物 |
10.下列表示物质结构的化学用语正确的是( )
| A. | 乙酸的结构简式:CH3COOH | B. | Na2O2中氧元素的化合价为-2 | ||
| C. | Cl-的结构示意图: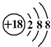 | D. | 乙烯的结构简式CH2CH2 |
17.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯酚与浓溴水可直接反应,而苯与液溴反应则需要FeBr3作催化剂 |
14.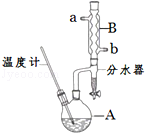 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如表
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振荡后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振荡后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(7)本实验中,正丁醚的产率为34%.(保留两位有效数字)
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如表
| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振荡后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振荡后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
(7)本实验中,正丁醚的产率为34%.(保留两位有效数字)
15.下列叙述正确的是( )
| A. | 常温下NO2是无色气体,能与水发生反应 | |
| B. | SiO2难溶于水,不能与NaOH溶液反应 | |
| C. | 浓硝酸能与铜反应生成H2 | |
| D. | 实验室常用NH4Cl和Ca(OH)2固体混合物加热来制取NH3 |
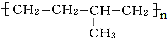 的链节为-CH2-CH2-CH(CH3)-CH2-.
的链节为-CH2-CH2-CH(CH3)-CH2-.