题目内容
5.实验室需要0.10mol•L-1的硫酸920mL,某同学欲用密度为1.84g•cm-3、溶质的质量分数为98%的浓硫酸进行配制.试回答:(1)需选用D容量瓶(填序号).
A.50mL B.100mL C.250mL D.1000mL
(2)需量取98%浓硫酸的体积为5.4mL.
(3)此实验中玻璃棒的作用是搅拌、引流.
(4)若提供如下仪器:
A.量筒 B.托盘天平 C.玻璃棒D.容量瓶 E.胶头滴管 F.烧杯
完成该实验不需要的仪器B(填仪器标号).
(5)下列操作会使所配制的溶液物质的量浓度一定偏低的是BC.
A.容量瓶底部有蒸馏水
B.向容量瓶转移溶液时,有少量液体溅出
C.加水时,水量超过了刻度线
(6)下列关于容量瓶的使用方法中,正确的是AD(填序号).
A.使用前要检验是否漏水
B.在容量瓶中直接溶解固体或稀释液体
C.溶液未经冷却即注入容量瓶中
D.向容量瓶中转移溶液要用玻璃棒引流.
分析 (1)选取的容量瓶规格应该等于或稍大于需要配制溶液的体积;
(2)根据C=$\frac{1000ρω}{M}$计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算;
(3)依据稀释、移液操作过程中玻璃棒作用解答;
(4)依据配制一定物质的量浓度溶液一般步骤选项需要仪器;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)根据正确使用容量瓶的操作方法判断.
解答 解:(1)实验室需要0.10mol•L-1的硫酸920mL,应选择1000mL容量瓶;
故选:D.
(2)浓硫酸的浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.10mol/L×1L,V=0.0054L=5.4mL,
故答案为:5.4;
(3)在稀释浓硫酸操作时,需要用玻璃棒搅拌,在移液时应用玻璃棒引流;
故答案为:搅拌、引流;
(4)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,用到的仪器:量筒、烧杯、玻璃棒、1000mL容量瓶、胶头滴管,用不到托盘天平;
故选:B;
(5)A.容量瓶底部有蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故A不选;
B.向容量瓶转移溶液时,有少量液体溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B选;
C.加水时,水量超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故C选;
故选:BC;
(6)(5)A.使用前要检验是否漏水,故正确;
B.容量瓶不能用来稀释浓溶液或溶解固体,只能用来配制溶液,故错误;
C.溶液未经冷却即注入容量瓶中,导致溶液体积偏小,配制浓度偏大,故错误;
D.向容量瓶中转移溶液要用玻璃棒引流,防止液体溅出,故正确;
故选AD.
点评 本题考查一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶和量筒规格的选取方法及误差分析,为易错点.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 电解精炼铜时粗铜做阳极,发生的电极反应为Cu2++2e-=Cu | |
| B. | 一定条件下,使用催化剂能同时提高反应速率和反应物的平衡转化率 | |
| C. | NH4HSO4溶液呈酸性,主要原因是NH4+的水解促进了水的电离 | |
| D. | 常温下加水稀释CH3COOH 溶液,稀释过程中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$不变 |
| A. | 食用白糖的主要成分是蔗糖 | B. | 纤维素不能水解成葡萄糖 | ||
| C. | 蛋白质水解的最终产物是多肽 | D. | 植物油的主要成分是高级脂肪酸 |
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 比例模型 可以表示甲烷分子,不可以表示四氯化碳分子 可以表示甲烷分子,不可以表示四氯化碳分子 | |
| D. | 丙烷的结构简式:CH3CH2CH3 |
| A. | 葡萄糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 纤维素 |
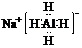 ,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.



