题目内容
7.W、X、Y、Z均为短周期主族元素,原子序数依次增加,X与Y形成的化合物能与水反应生成酸且X、Y同主族,两元素核电荷数之和与W、Z的原子序数之和相等,则下列说法正确的是( )| A. | Z元素的含氧酸是最强酸 | B. | 原子半径:X>Z | ||
| C. | 气态氢化物热稳定性:W>X | D. | W与Y可以存在于同一离子化合物中 |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,X与Y形成的化合物能与水反应生成酸且X、Y同主族,则X为O元素,Y为S元素,O、S元素核电荷数之和与W、Z的原子序数之和相等,则W、Z的原子序数之和24,而且W的原子序数小于O,Z的原子序数大于S,则Z为Cl元素,所以W的原子序数为24-17=7,即W为N元素;结合元素化合物性质判断和元素周期律分析解答.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,X与Y形成的化合物能与水反应生成酸且X、Y同主族,则X为O元素,Y为S元素,O、S元素核电荷数之和与W、Z的原子序数之和相等,则W、Z的原子序数之和24,而且W的原子序数小于O,Z的原子序数大于S,则Z为Cl元素,所以W的原子序数为24-17=7,即W为N元素;
A、Z为Cl元素,Cl元素的最高价含氧酸是最强酸,其它价态的含氧酸的酸性不一定强,如HClO是弱酸,故A错误;
B、电子层越多,原子半径越大,所以O<Cl,即原子半径:X<Z,故B错误;
C、元素的非金属性越强,其氢化物越稳定,非金属性O>N,所以气态氢化物热稳定性:W<X,故C错误;
D、N与S可以存在于同一离子化合物中,如硫酸铵中含有N、S,故D正确.
故选:D.
点评 本题以元素推断为载体,考查原子结构位置与性质关系、元素化合物知识,题目难度不大,推断元素是解题的关键.

练习册系列答案
相关题目
17.某实验中需要0.20mol•L-1的Na2CO3溶液950mL,配置该溶液时应选用的容量瓶规格和称取的碳酸钠质量分别是( )
| A. | 950mL、20.14g | B. | 950mL、10.07g | C. | 1000mL、21.20g | D. | 1000mL、10.60g |
18.已知:①2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ/mol
②H2S(g)═H2(g)+S(g)△H=+20.1KJ/mol
下列判断中正确的是( )
②H2S(g)═H2(g)+S(g)△H=+20.1KJ/mol
下列判断中正确的是( )
| A. | 氢气的燃烧热△H=-241.8KJ/mol | |
| B. | 相同条件下,充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1mol H2S(g)放热多20.1kJ | |
| C. | 由①②知,水的热稳定性小于硫化氢 | |
| D. | ②中生成固态硫,△H将增大 |
2.化学创造美好生活.以下说法不正确的是( )
| A. | 利用化学工艺调整织物孔隙直径,可以制作出防水透气面料 | |
| B. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如生石灰和硅胶 | |
| C. | 合金广泛应用于现代建筑业,与金属晶体的韧性、可塑性有关 | |
| D. | 使用无铅汽油的汽车尾气不会污染空气 |
19.工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下,S02被空气中的02氧化为S03.

(1)V205是钒催化剂的活性成分,郭汗贤等提出:V205在对反应I的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如图1:
①关气体分子中1mol化学键断裂时需要吸收的能量数据如下:
由此计算反应I的△H=-98kJ•mol-1.
②反应Ⅱ、Ⅲ的化学方程式为S02+V205?V204•S03、2V204•S03+02?2V205+S03.
(2)某实验从废钒催化剂(主要成分为V2O5和V2O4)中回收V2O5,其简要过程如下:

(DVO2+和V02+可看成是钒相应价态的简单阳离子完全水解的产物).①写出水解生成V02+的离子方程式:V5++2H2O=V02++4H+.
②在沉钒时,为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol/L[25℃,Ksp(NH4VO3)=1.6×10 -3,溶液体积变化忽略不计].
(3)在保持体系总压为0.1MPa的条件下进行反应:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g),原料气中SO2和02的物质的量之比(k)不同时,S02的平衡转化率与温度(t)的关系如2图所示:
①图中k1、k2、k3的大小顺序为k1>k2>k3,理由是相同温度和压强下,K值减小,氧气浓度越大,平衡正向移动,二氧化硫转化率提高.
②该反应的化学平衡常数Kp表达式为Kp=$\frac{P(S{O}_{3})}{P(S{O}_{2}){P}^{\frac{1}{2}}({O}_{2})}$(用平衡分压代替平衡浓度表示).图中A点原料气的成分是:n(SO2):n(O2):n(N2)=7:11:82,达平衡时SO2的分压p( SO2)的计算式为_$\frac{0.1×12%×7}{12%×7+11-0.5×88%×7+88%×7+82}$(分压=总压×物质的量分数).
③近年,有人研发出用氧气代替空气的新工艺,使SO2趋于完全转化.此工艺的优点除了能充分利用含硫的原料外,主要还有无尾气排放,不污染环境.

(1)V205是钒催化剂的活性成分,郭汗贤等提出:V205在对反应I的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如图1:
①关气体分子中1mol化学键断裂时需要吸收的能量数据如下:
| 化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
| 能量/KJ | 535 | 496 | 472 |
②反应Ⅱ、Ⅲ的化学方程式为S02+V205?V204•S03、2V204•S03+02?2V205+S03.
(2)某实验从废钒催化剂(主要成分为V2O5和V2O4)中回收V2O5,其简要过程如下:

(DVO2+和V02+可看成是钒相应价态的简单阳离子完全水解的产物).①写出水解生成V02+的离子方程式:V5++2H2O=V02++4H+.
②在沉钒时,为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为0.8mol/L[25℃,Ksp(NH4VO3)=1.6×10 -3,溶液体积变化忽略不计].
(3)在保持体系总压为0.1MPa的条件下进行反应:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g),原料气中SO2和02的物质的量之比(k)不同时,S02的平衡转化率与温度(t)的关系如2图所示:
①图中k1、k2、k3的大小顺序为k1>k2>k3,理由是相同温度和压强下,K值减小,氧气浓度越大,平衡正向移动,二氧化硫转化率提高.
②该反应的化学平衡常数Kp表达式为Kp=$\frac{P(S{O}_{3})}{P(S{O}_{2}){P}^{\frac{1}{2}}({O}_{2})}$(用平衡分压代替平衡浓度表示).图中A点原料气的成分是:n(SO2):n(O2):n(N2)=7:11:82,达平衡时SO2的分压p( SO2)的计算式为_$\frac{0.1×12%×7}{12%×7+11-0.5×88%×7+88%×7+82}$(分压=总压×物质的量分数).
③近年,有人研发出用氧气代替空气的新工艺,使SO2趋于完全转化.此工艺的优点除了能充分利用含硫的原料外,主要还有无尾气排放,不污染环境.
17. 我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
 我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 与乙醇发生酯化反应生成产物的分子式为C8H18O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物可以发生银镜反应 | |
| D. | 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 |
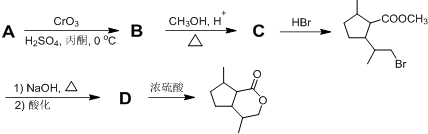
 ,B含有的官能团的名称是羧基、碳碳双键.
,B含有的官能团的名称是羧基、碳碳双键.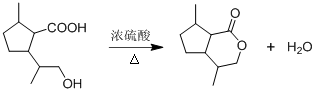 .
. ,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号).
,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号). ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.
 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)
 .
. .
. .
.