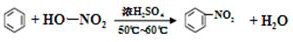题目内容
12.在一个恒容的密闭容器中充入2mol A和1mol B发生反应:2A(g)+B(g)?xC(g),达到平衡后,C的体积分数为a.若恒温恒容下,按0.6mol A、0.3mol B和1.4mol C为起始物,达到平衡后,C的体积分数仍为a,则x的值可能是( )| A. | 2 | B. | 3 | C. | 4 | D. | 2 或 3 |
分析 恒温恒容下,开始充入2molA和1molB与开始充入0.6molA、0.3molB和1.4molC达到平衡后,C的体积分数为a,说明为完全等效平衡,按化学计量数转化到左边,满足n(A)=2mol、n(B)=1mol,据此解答.
解答 解:恒温恒容下,开始充入2molA和1molB与开始充入0.6molA、0.3molB和1.4molC达到平衡后,C的体积分数为a,说明为完全等效平衡,按化学计量数转化到左边,满足n(A)=2mol、n(B)=1mol,
故0.6mol+$\frac{2.8}{x}$=2mol,
解得x=2,
但是对于反应前后气体系数和相等的反应,物质的投料等比即等效,所以x=3也是正确的.
故选:D.
点评 本题考查化学平衡计算、等效平衡等,难度中等,理解等效平衡规律:恒温恒容,反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比例即可.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 所有反应的反应热都可以由实验直接测定 | |
| B. | 任何化学反应都需要用活化能来引发 | |
| C. | 200°C、101KPa时,1g氢气与碘蒸气作用生成HI气体,放出7.45kJ热量,则此过程的热化学方程式可表示为:H2(g)+I2(g)=2HI(g)△H=-14.9kJ/mol | |
| D. | 没有物质的变化,就不能引发能量的变化 |
3.某同学在实验报告中有以下实验数据:①用托盘天平称取11.7g食盐;②用量筒量取5.26 mL盐酸;③用160mL容量瓶配制160mL 1 mol/L KCl溶液,其中数据合理的是( )
| A. | ① | B. | ②③ | C. | ①③ | D. | ② |
17.下列溶液中氯离子的浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是( )
| A. | 150mL1mol/L NaCl溶液 | B. | 75mL2mol/L NH4Cl溶液 | ||
| C. | 150mL3mol/L KCl溶液 | D. | 75mL1mol/L CuCl2溶液 |
4.a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如表所示:
由上述现象可推知a、b、c、d依次是( )
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | AgNO3、HCl、BaCl2、Na2CO3 | B. | HCl、BaCl2、AgNO3、Na2CO3 | ||
| C. | BaCl2、Na2CO3、AgNO3、HCl | D. | AgNO3、HCl、Na2CO3、BaCl2 |
1.下列实验设计方案中,可行的是( )
| A. | 用加入适量铁粉的方法除去Cu(NO3)2溶液中混有的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 | |
| D. | 先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |


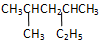 的系统命名是:2,4-二甲基己烷
的系统命名是:2,4-二甲基己烷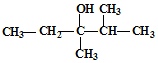 的键线式是
的键线式是
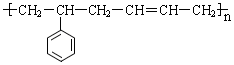 的单体结构简式为:
的单体结构简式为: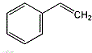 和CH2=CH-CH=CH2
和CH2=CH-CH=CH2