题目内容
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]-、MnO4-、CO32-、SO42-中的若干种离子组合,取溶液进行如下连续试验:(填化学用语)

(1)气体A的成分是: ,气体B的成分是
(2)X溶液中一定存在的离子是:
(3)写出步骤①发生反应的所有离子反应方程式:
(4)写出步骤②形成白色沉淀甲的离子方程式:
(5)写出白色沉淀乙的可能组成: .

(1)气体A的成分是:
(2)X溶液中一定存在的离子是:
(3)写出步骤①发生反应的所有离子反应方程式:
(4)写出步骤②形成白色沉淀甲的离子方程式:
(5)写出白色沉淀乙的可能组成:
考点:离子方程式的书写,常见离子的检验方法
专题:离子反应专题
分析:溶液呈无色,则一定不含MnO4-,
1、取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液,说明溶液中含有CO32-;
2、在(Ⅰ)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲,说明(Ⅰ)中含有Al3+;
3、在(Ⅱ)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙,该气体为氨气,沉淀为BaCO3或BaSO4.
结合离子共存问题解答该题.
1、取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液,说明溶液中含有CO32-;
2、在(Ⅰ)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲,说明(Ⅰ)中含有Al3+;
3、在(Ⅱ)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙,该气体为氨气,沉淀为BaCO3或BaSO4.
结合离子共存问题解答该题.
解答:
解:溶液呈无色,则一定不含MnO4-,
1、取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液,说明溶液中含有CO32-,则一定不含Ag+、Ba2+、Al3+;
2、在(Ⅰ)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲,说明(Ⅰ)中含有Al3+,则原溶液中含有AlO2-;
3、在(Ⅱ)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙,该气体为氨气,沉淀为BaCO3或BaSO4,不能确定原溶液中是否含有SO42-,
根据溶液电中性原则可知含有Na+,所以溶液中一定含有Na+、CO32-、AlO2-,
所以:
(1)气体A的成分是:二氧化碳,气体B的成分是氮气,故答案为:CO2;NH3;
(2)X溶液中一定存在的离子是:Na+、CO32-、AlO2-,故答案为:Na+、CO32-、AlO2-;
(3)写出步骤①发生反应的所有离子反应方程式:CO32-+2H+=CO2↑+H2O、AlO2-+4H+=Al3++2H2O,故答案为:CO32-+2H+=CO2↑+H2O、AlO2-+4H+=Al3++2H2O;
(4)写出步骤②形成白色沉淀甲,是铝离子和碳酸氢根离子发生双水解,生成氢氧化铝,反应的离子的方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(5)溶液中含有碳酸根离子可能含有硫酸根离子所以加过量的氢氧化钡生成白色沉淀一定含有碳酸钡,可能有硫酸钡,故答案为:一定含有碳酸钡,可能有硫酸钡.
1、取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液,说明溶液中含有CO32-,则一定不含Ag+、Ba2+、Al3+;
2、在(Ⅰ)所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲,说明(Ⅰ)中含有Al3+,则原溶液中含有AlO2-;
3、在(Ⅱ)所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙,该气体为氨气,沉淀为BaCO3或BaSO4,不能确定原溶液中是否含有SO42-,
根据溶液电中性原则可知含有Na+,所以溶液中一定含有Na+、CO32-、AlO2-,
所以:
(1)气体A的成分是:二氧化碳,气体B的成分是氮气,故答案为:CO2;NH3;
(2)X溶液中一定存在的离子是:Na+、CO32-、AlO2-,故答案为:Na+、CO32-、AlO2-;
(3)写出步骤①发生反应的所有离子反应方程式:CO32-+2H+=CO2↑+H2O、AlO2-+4H+=Al3++2H2O,故答案为:CO32-+2H+=CO2↑+H2O、AlO2-+4H+=Al3++2H2O;
(4)写出步骤②形成白色沉淀甲,是铝离子和碳酸氢根离子发生双水解,生成氢氧化铝,反应的离子的方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(5)溶液中含有碳酸根离子可能含有硫酸根离子所以加过量的氢氧化钡生成白色沉淀一定含有碳酸钡,可能有硫酸钡,故答案为:一定含有碳酸钡,可能有硫酸钡.
点评:本题考查离子的推断和离子共存问题,题目难度中等,本题注意根据物质反应的现象进行推断,易错点为SO42-的确定.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
| A、密度之比为14:15 |
| B、体积相等时具有的电子数相等 |
| C、原子数相等时具有的中子数相等 |
| D、质量相等时具有的质子数相等 |
下列化学方程式改写成离子方程式不正确的是( )
| A、CuCl2+2NaOH=Cu(OH)2↓+2NaCl Cu2++2OH-=Cu(OH)2↓ |
| B、BaCO3+2HCl=BaCl2+CO2↑+H2O CO32-+2H+=CO2↑+H2O |
| C、Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3 Ca2++CO32-=CaCO3↓ |
| D、2KOH+H2SO4=K2SO4+2H2O H++OH-=H2O |
下列反应不属于取代反应的是( )
A、CH2═CH2+H2
| |||
B、 +HNO3 +HNO3
| |||
C、CH3CH2OH+CH3COOH
| |||
D、CH4+Cl2
|
 某金属(A)在TK以下晶体的基本结构单元如图1所示,T K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同
某金属(A)在TK以下晶体的基本结构单元如图1所示,T K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:
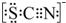 .
. 煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)?CH3OH(g)
煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)?CH3OH(g)