题目内容
1.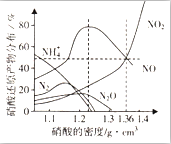 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
分析 A.根据图片知,硝酸和Fe反应有多种含氮微粒生成;
B.密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+,最低的是二氧化氮;
C.该硝酸物质的量浓度=$\frac{1{0}^{3}ρω}{M}$mol/L=$\frac{1000×1.26×50%}{63}$=10mol/L,若取该试剂10ml配成100ml溶液,所得溶液物质的量浓度是1mol/L;
D.当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,酸性硝酸亚铁和二氧化氮、NO.
解答 解:A.根据图片知,硝酸和Fe反应有多种含氮微粒生成,且一定有NO生成,故A正确;
B.根据图片知,密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+,最低的是二氧化氮,故B正确;
C.该硝酸物质的量浓度=$\frac{1{0}^{3}ρω}{M}$mol/L=$\frac{1000×1.26×50%}{63}$=10mol/L,若取该试剂10ml配成100ml溶液,所得溶液物质的量浓度是1mol/L,则pH=0,故C错误;
D.当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,酸性硝酸亚铁和二氧化氮、NO,根据转移电子相等知,反应方程式为4Fe+20HNO3=4Fe(NO3)3+3NO↑+3NO2↑+10H2O,则消耗的铁与被还原的硝酸物质的量之比为4mol:6mol=2:3,故D错误;
故选CD.
点评 本题以硝酸为载体考查物质的量浓度计算、硝酸性质等知识点,正确获取图片信息是解本题关键,难点是C中质量分数与物质的量浓度之间的换算,题目难度不大.

练习册系列答案
相关题目
7. 室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
 室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )
室温下,把SiO2细粉放入蒸馏水中,搅拌至平衡,生成H4SiO4溶液(SiO2+2H2O?H4SiO4),该反应平衡常数K随温度的变化如图示,搅拌1小时,测得H4SiO4的质量分数为0.01%(溶液密度为1.0g/mL),下列分析正确的是( )| A. | 该反应平衡常数的表达式为K=c(H4SiO4) | |
| B. | 该生成H4SiO4的反应为吸热反应 | |
| C. | 用H4SiO4表示的反应速率为1.04×10-2mol/(L•h) | |
| D. | 若K值变大,在平衡移动时逆反应速率先减小后增大 |
8.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24LCCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6 g铁粉在2.24l(标准状况)氯气中充分燃烧,失去的电子数为0.3NA | |
| D. | 常温常压下,10 g46%酒精水溶液中含氧原子总数为0.1NA |
12.黑火药爆炸时可发生如下反应:4S+16KNO3+16C→3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
| A. | KNO3只发生氧化反应 | B. | 反应消耗12g C时电子转移5mol | ||
| C. | 还原产物只有K2S和 N2 | D. | 被氧化与被还原的S为1:3 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,32g O2和16g O3的混合物中,含有O原子数目为2NA | |
| B. | 标准状况下,1mol Na2O 和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为 $\frac{2}{3}$NA |
10.分子式为C4H8O2,且含有-COO-结构的同分异构体有几种( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
11.在研究物质变化时,人们可以从不同的角度,不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( )
| A. | 化学反应的实质是旧键的断裂和新化学键生成 | |
| B. | 所有化学变化一定遵循质量守恒和能量守恒 | |
| C. | 在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 | |
| D. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.