题目内容
6. 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液.其金属性比铜强(填“强”或“弱”)
(2)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(3)工业上净化处理铬污染的可用电解法.将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe作阳极和石墨作阴极进行电解.经过一段时间后,溶液中Cr和Fe转化为Cr(OH)3和Fe(OH)3沉淀除去.
①写出阴极的电极反应式:2H++2e-=H2↑.
②溶液中Fe、Cr元素最终转化为Fe(OH)3和Cr(OH)3沉淀除去,原理为阳极Fe-2e-=Fe2+,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,消耗H+,同时阴极H+放电,c(OH-)增大,Fe3+、Cr3+结合OH-转化为沉淀(用离子方程式和必要的文字说明).
③电解后的溶液中c(Fe3+)为2.0×10-13 mol•L-1,则溶液中c(Cr3+)为3×10-6mol•L-1(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31).
(4)CrO3具有强氧化性,可用于查处酒驾,原理是在酸性条件下能将乙醇氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],则该反应的化学方程式为4CrO3+3CH3CH2OH+6H2SO4→2Cr2(SO4)3+3CH3COOH+9H2O.
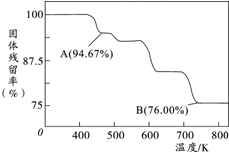
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率 $\frac{固体样品剩余质量}{固体样品初始质量}$×100%随温度的变化如图所示,则B点时剩余固体的成分是Cr2O3(填化学式).
分析 (1)铜排在金属活动性顺序表中H的后面,不能与硫酸反应,据此解答即可;
(2)氢氧化铝与氢氧化钾反应生成偏铝酸钾和水,据此书写;
(3)①阴极上是阳离子发生得电子的还原反应,据此书写电极反应;
②Fe3+、Cr3+在水溶液中会发生水解反应,当溶液的碱性达到一定程度就会生成氢氧化物沉淀;
③根据电解后溶液中c(Fe3+),由KsP[Fe(OH)3]计算溶液中c(OH-),再根据KsP[Cr(OH)3]计算溶液中c(Cr3+);
(4)根据化合价升降总数相等以及原子守恒来解答;
(5)根据质量守恒定律,在变化过程中,Co的质量没有变,求出氧原子和铬原子的个数比即可.
解答 解:(1)在常温下,铬能缓慢与稀硫酸反应,而Cu不能与稀硫酸反应,说明Cr金属活泼性较强,故答案为:强;
(2)Cr(OH)3和Al(OH)3类似,氢氧化铝与氢氧化钾反应生成偏铝酸钾和水,故Cr(OH)3与KOH反应生成KCrO2,离子反应方程式为:Cr(OH)3+OH-=CrO2-+2H2O,故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(3)①用Fe为电极进行电解,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上是阳离子发生得电子的还原反应,即2H++2e-═H2↑,故答案为:2H++2e-═H2↑;
②在电解池的阳极:Fe-2e-═Fe2+,Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Cr2O72-与Fe2+反应的过程中,将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀,故答案为:阳极Fe-2e-=Fe2+,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,消耗H+,同时阴极H+放电,c(OH-)增大,Fe3+、Cr3+结合OH-转化为沉淀;
③电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=$\frac{4×1{0}^{-38}}{2×1{0}^{-13}}$mol/L=2×10-25mol/L,故溶液中c(Cr3+)=$\frac{6×1{0}^{-31}}{2×1{0}^{-25}}$mol/L=3×10-6mol/L,
故答案为:3×10-6;
(4)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O,故答案为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O;
(5)设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×$\frac{52}{52+16×3}$=52g,B点时固体的质量为:100g×76%=76g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}:\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,故答案为:Cr2O3.
点评 本题考查了离子方程式和电极反应式的书写,难度不大,注意(5)题中,在变化过程中,Co的质量没有变,是解题的关键.

| A. | 二氧化硅是制造玻璃、光导纤维的原料 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | NOx、CO2、PM2.5颗粒都会导致酸雨 |
| A. | 0.1 mol•L-1Ba(OH)2溶液中含有0.2nA个OH- | |
| B. | 1mol Na与足量水反应,转移2nA个电子 | |
| C. | 常温常压下,22.4L乙烯含有nA个CH2=CH2分子 | |
| D. | 常温常压下,46g NO2含有2nA个氧原子 |
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}•H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{CI_{2}}{→}$Br2$\stackrel{鼓入热空气}{→}$Br2(粗产品)$\stackrel{精制}{→}$Br2 | |
| C. | MnO2$→_{加热}^{浓HCI}$Cl2$\stackrel{Ca(OH)_{2}}{→}$漂白粉 | |
| D. | 石油$\stackrel{裂解}{→}$乙烯$→_{加热}^{催化剂}$聚乙烯 |
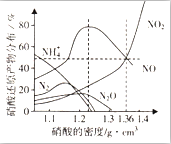 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
| A. | A+离子半径小于B+离子半径 | |
| B. | B是其所在主族元素中金属性最强的 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
(1)F元素价层电子排布式为3d64s4.
(2)关于B2A2的下列说法中正确的是②④.
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键形成的非极性分子
③每个B2A2分子中σ键和π键数目比为1:1
④B2A2分子中的A-B键属于s-spσ键
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为N>O>C(用元素符号表示).B、C、D三种元素中与BD2互为等电子体的分子式为N2O.(用元素符号表示)
(4)A2E分子中心原子的杂化类型为sp3.比较A2D与A2E分子的沸点,其中沸点较高的原因为H2O分子之间存在氢键.元素D可形成两种同素异形体,其中在水中溶解度更大的是O3(填分子式).
(5)F单质的晶体在不同温度下有两种堆积方式,信息如下:
| 序号 | 堆积方式 | 晶胞棱长(cm) |
| Ⅰ | 面心立方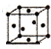 | a |
| Ⅱ | 体心立方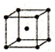 | b |
H2(g)+Cl2(g)→2HCl(g)+Q1
H2(g)+Br2(g)→2HBr(g)+Q2 根据上述反应做出的判断正确的是( )
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1mol HCl(g)放出Q1热量 | |
| D. | 等物质的量时,Br2(g)具有的能量低于Br2(l) |
 CO2:
CO2: MgCl2:
MgCl2: Na2O2:
Na2O2: .
.